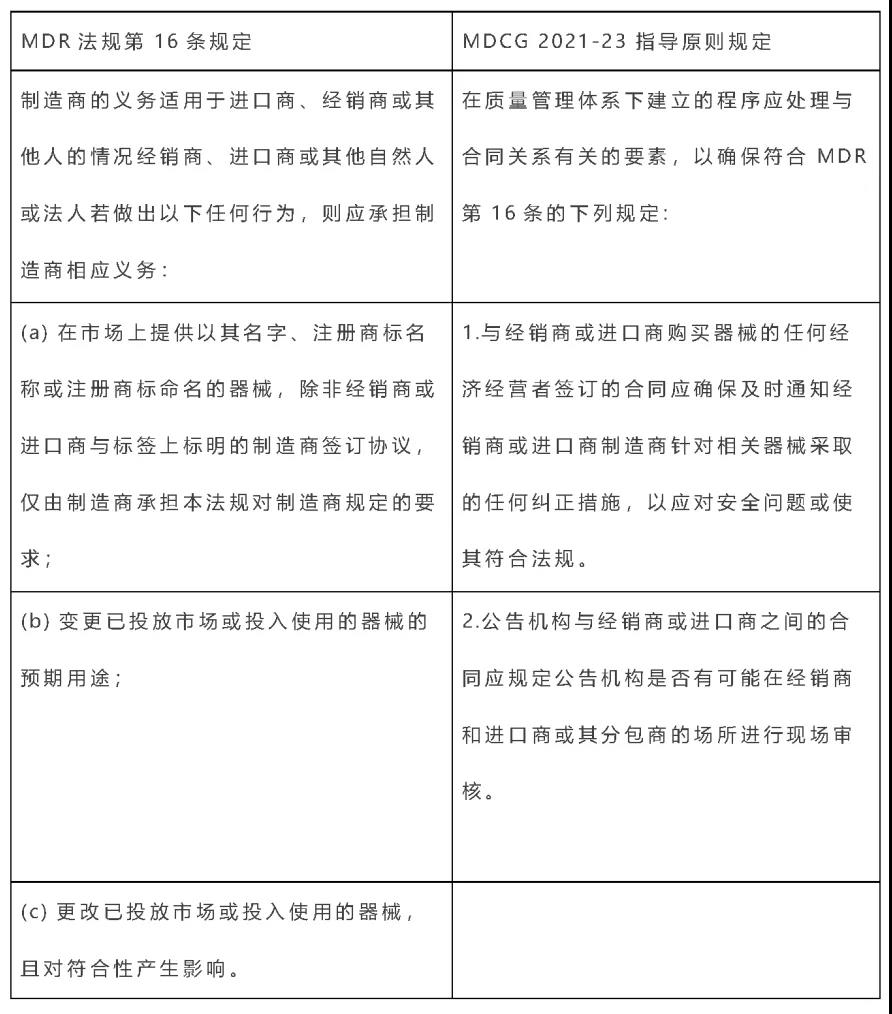
上周,MDCG发布了2021-23指南文件。对于(EU) 2017/745 (MDR)法规的第16(4) 条:制造商的义务适用于进口商、经销商或其他人的情况,该指南给公告机构提供了一份指导,要求公告机构建立必要的评估活动。同时也为三级经济运营商升级到制造商的认证路径(即:分销商和进口商提供的MDR认证申请)做了澄清和指导。对于广大的医疗器械贸易公司、进口商及经销商,并以Re-labeling或Re-package经销医疗器械的企业,满足质量管理体系要求,承担制造商的义务,并取得公告机构的认证。
质量管理体系应至少涵盖并解决以下问题:
01
管理体系的文件,包括管理层的责任,以及政策和程序的制定
02
资源管理,包括开展第 16 条第 (2) 款 (a) 和 (b) 点所述活动所需的场所和器械,以及供应商和分包商的选择和控制
03
确保经销商或进口商获悉制造商为应对安全问题或使其符合法规而采取的与相关器械相关的任何纠正措施的程序(第 16 条第 2 款 (a) 项和 (b)项)
04
纠正措施的管理,包括处理因第 16(2) 条 (a) 和 (b) 点开展的活动导致的不合格器械和市场召回的程序,包括必要时的现场安全纠正措施和有效性验证
05
确保器械可追溯性的程序以及表明对产品所做更改的标签、使用说明和外包装
06
文档控制
07
记录控制
08
监督质量管理体系的实施和维护,包括内部审核和管理审查
质量管理体系应能够支持和证明符合第16(3)条MDR / IVDR要求的一致性。
MDCG 2021-23详细指导文件






