关于欧盟MDR认证/IVDR认证法规的修订,我们在9月份的推文【欧盟预将MDR提速?】CE法规(MDR/IVDR) 即将迎来大规模修订!做了重点关注。在文中提到公众反馈截止日期为10月6日,现在让我们来盘点一下后续的进度吧。
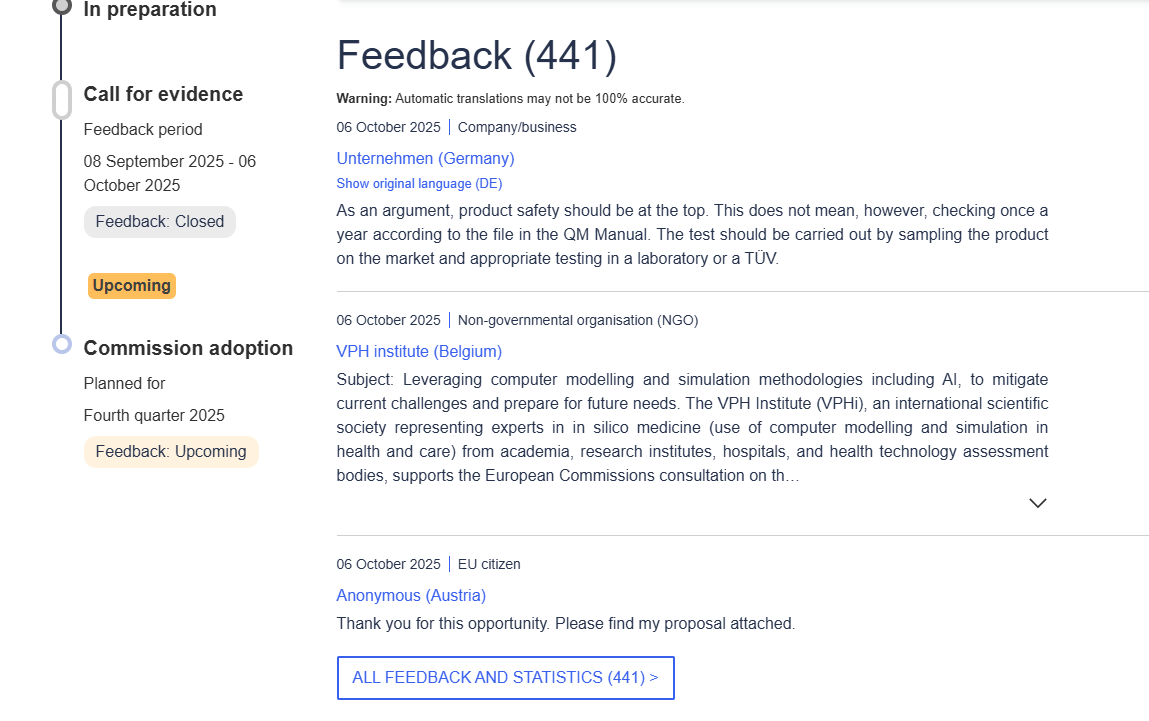
目前,公众反馈已经截止,这期间共收集到了441条反馈意见。在反馈期结束后,委员会将着手根据意见进行修订。欧盟委员会将于2025年第四季度进行磋商,在磋商结束后不久,或会出台一份法规修订案草案。
在征集意见期间收集到的441条反馈,一半来自企业,另一半来自非企业组织包括个人,其中提出意见最多的国家是德国(104条),而中国提出了9条意见。
l 小编总结了4条最普遍性的提议如下:
1. 延长法规合规过渡期,缓解企业执行压力
核心内容:多数医疗器械企业(尤其是中小企业)提出,MDR 和 IVDR 原合规截止日期过紧,部分产品的检测、认证流程尚未完成,请求欧盟延长特定品类(如中低风险医疗器械)的过渡期,避免因合规不及时导致产品断供。
提出群体:欧盟及全球范围内的中小型医疗器械生产商、行业协会。
2. 优化医疗器械分类规则,降低低风险产品合规成本
核心内容:行业反馈部分体外诊断器械(IVD)的分类过于严格,例如部分常规检测试剂(如普通血糖检测试剂)被划入较高风险类别,需满足更复杂的认证要求,提议欧盟重新评估这类产品的风险等级,对低风险产品简化分类和合规流程。
提出群体:IVD 产品生产商、临床医疗机构(从采购成本和供应稳定性角度支持)。
3. 提供更清晰的合规指导文件,减少解读歧义
核心内容:企业普遍反映 MDR 和 IVDR 部分条款表述模糊,不同成员国的监管机构对条款的解读存在差异,导致企业在合规过程中反复调整方案。提议欧盟委员会发布更详细的实施指南,统一各成员国的监管标准,明确检测、认证的具体操作流程。
提出群体:跨国医疗器械企业、欧盟成员国的医疗器械行业协会。
4. 简化 CE 认证跨境协调流程,降低中国出口企业成本(中国企业提出)
核心内容:中国医疗器械出口企业提出,目前向欧盟出口产品时,需应对不同成员国的 CE 认证附加要求,且部分检测项目需在欧盟境内重复进行,增加了时间和资金成本。提议欧盟建立统一的跨境认证协调机制,认可中国境内符合欧盟标准的检测机构出具的报告,减少重复检测。
提出群体:中国医疗器械行业协会、主要出口企业(如迈瑞医疗、鱼跃医疗等)。
更多反馈信息,请参考网站原文:https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/14808-Medical-devices-and-in-vitro-diagnostics-targeted-revision-of-EU-rules/feedback_en?p_id=20355