
欧洲委员会于当地时间2024年1月23日,发布最新提案:建议欧洲议会和理事会的规定修订MDR(欧盟医疗器械法规)和 IVDR认证(体外诊断器械法规),关于EUDAMED的逐步推出、供应中断时的信息义务和某些体外诊断医疗器械的过渡性规定。
本提案要解决的3个紧迫问题如下:
●IVDR最新延期提案
根据指令98/79/EC颁发并根据本条第2段有效的证书的设备可以在2027年12月31日之前投放市场或投入使用。
符合98/79/EC指令的合格评定程序不需要公告机构参与的设备,其符合性声明是在2022年5月26日之前根据该指令起草的,并且符合本法规的合格评定程序需要公告机构参与的设备,可以在以下日期之前投放市场或投入使用:
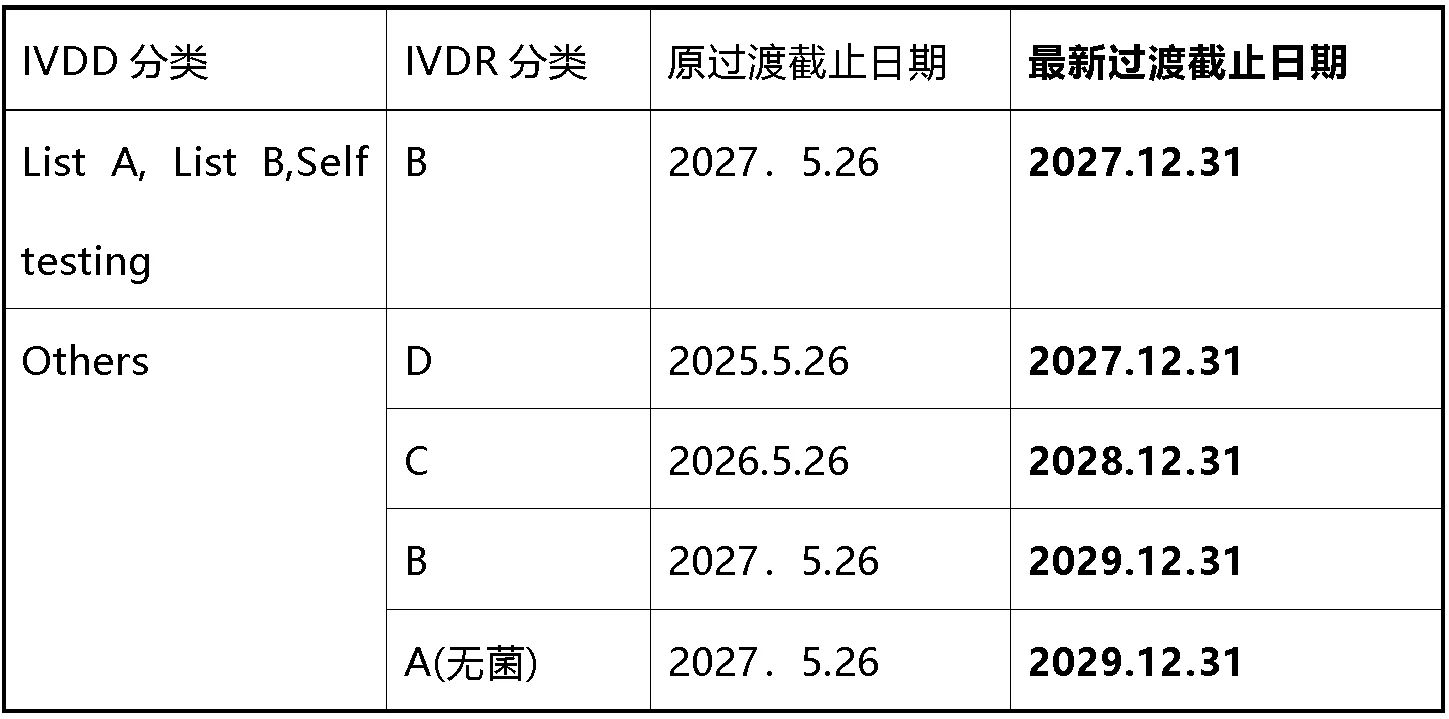
原文参考如下:

●EUDAMED的逐步推出
逐步推行已经集成到欧洲医疗器械数据库EUDAMED的模块的使用,而不用等所有模块开发全部完成。EUDAMED的使用,特别是对于设备和证书注册,经济运营商的信息,将有助于提高透明度及监控设备的可用性。
●供应中断时的信息义务
该提案旨在规定制造商有义务在暂时或永久停止供应关键设备之前通知其相关主管当局和卫生机构。如果制造商不直接向卫生机构或卫生保健专业人员供应,则应通知供应链中的相关经济经营者,由其通知卫生部门。