
2018年9月,国家药品监督管理局印发《关于公布新修订免于进行临床试验医疗器械目录的通告》(2018年第94号),对前期已发布的免于进行临床试验的医疗器械(及体外诊断试剂)目录进行了全面修订和汇总,分别印发了修订汇总后的《免于进行临床试验的医疗器械目录》和《免于进行临床试验的体外诊断试剂目录》。在此基础上,2019年12月,国家药品监督管理局印发《关于公布新增和修订的免于进行临床试验医疗器械目录的通告》(2019年第91号),公布了第一批新增和修订的免于进行临床试验的医疗器械(及体外诊断试剂)目录。
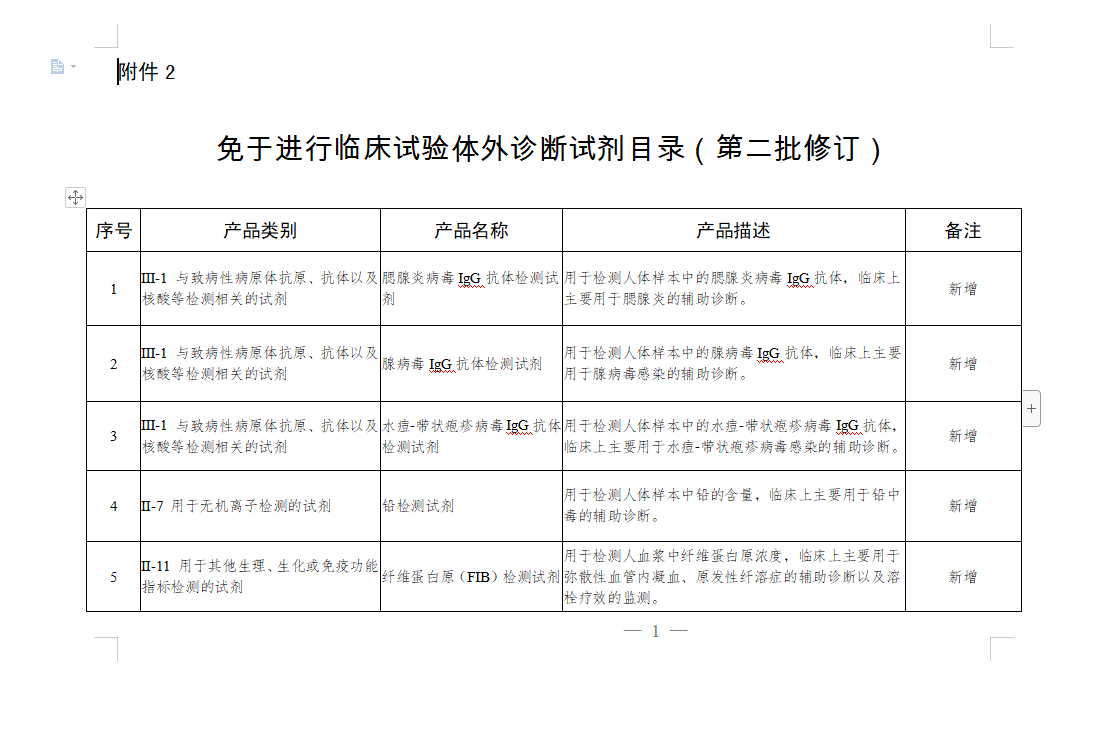
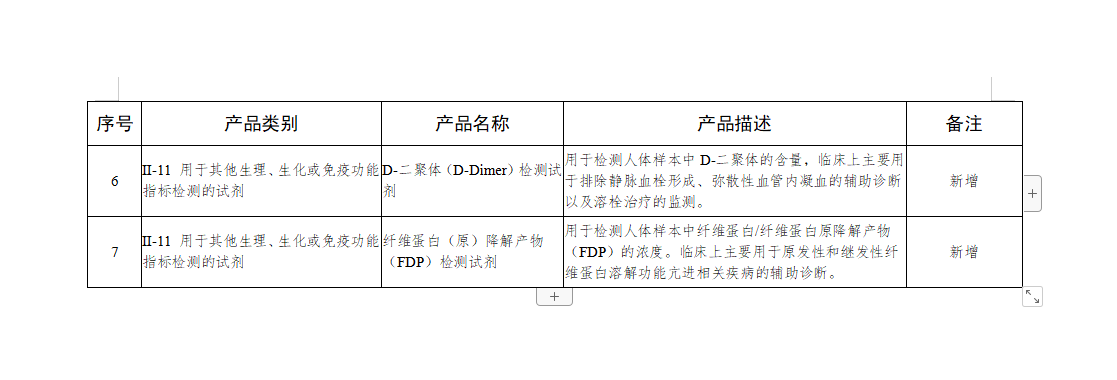
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院深化“放管服”改革有关要求,进一步做好医疗器械注册管理工作,根据《医疗器械监督管理条例》《医疗器械注册管理办法》《体外诊断试剂注册管理办法》,国家药品监督管理局组织新增和修订了第二批免于进行临床试验医疗器械(及体外诊断试剂)目录。现予以公布,自公布之日起施行。
来源:国家药品监督管理局
政策解读
1:目录内的二类、三类产品以后批准上市可以免于临床试验
2:促进相关医疗器械企业的发展
3:是简政放权的利民措施,将有限资源更多地给其他的监管,促进企业发展,强化落实企业主体责任。

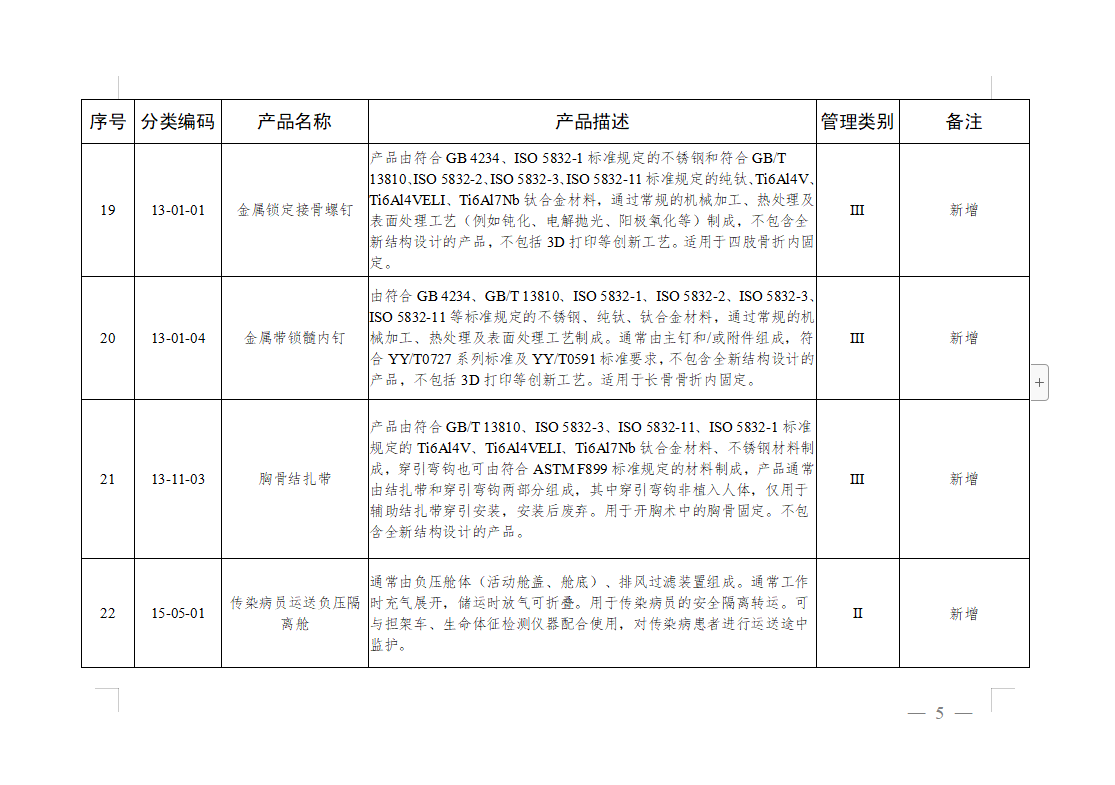
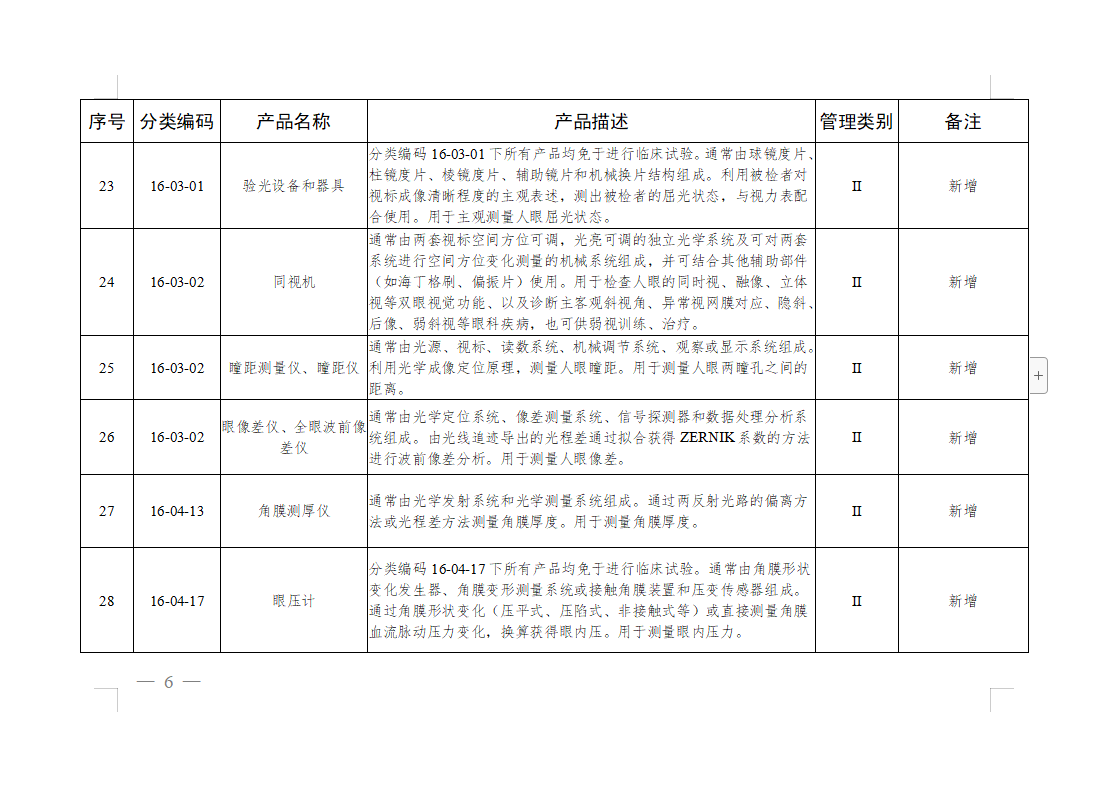
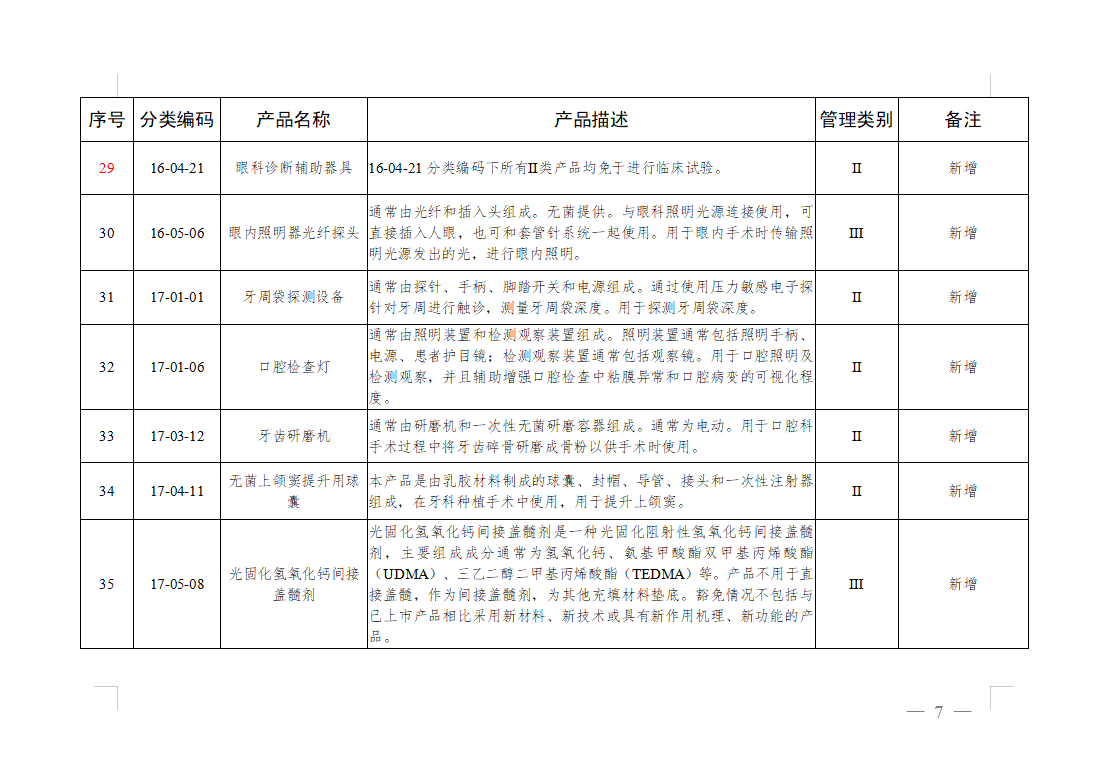
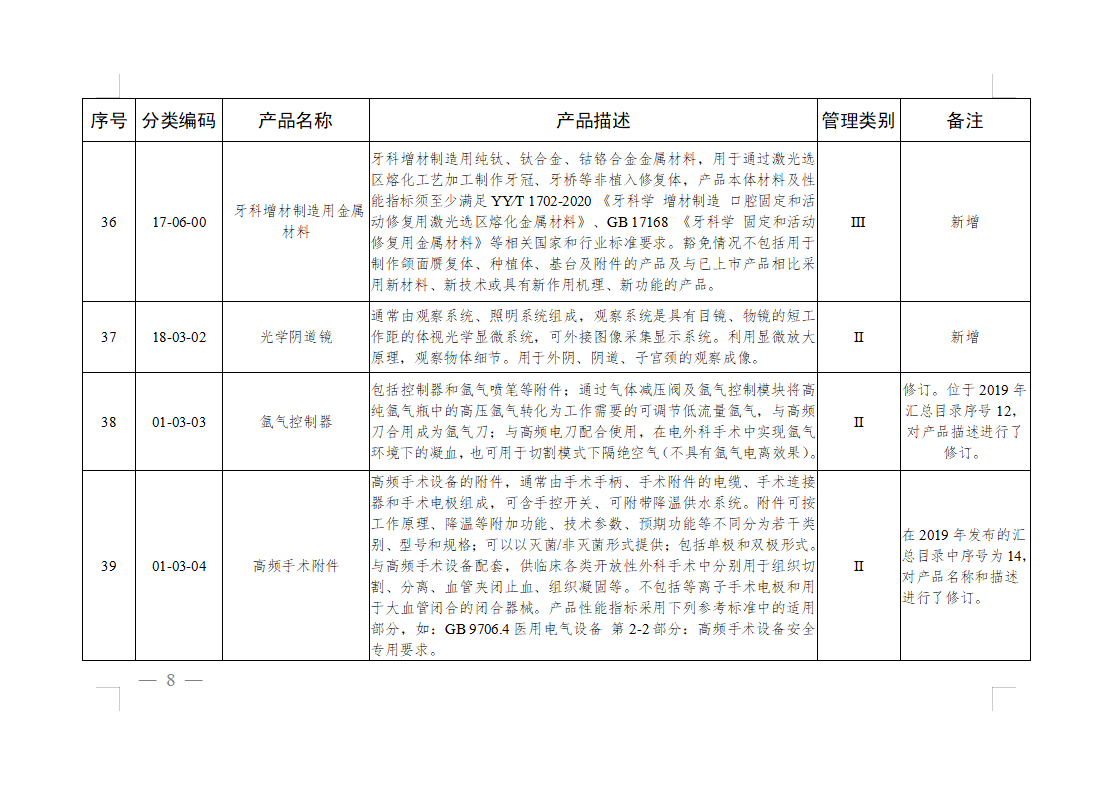
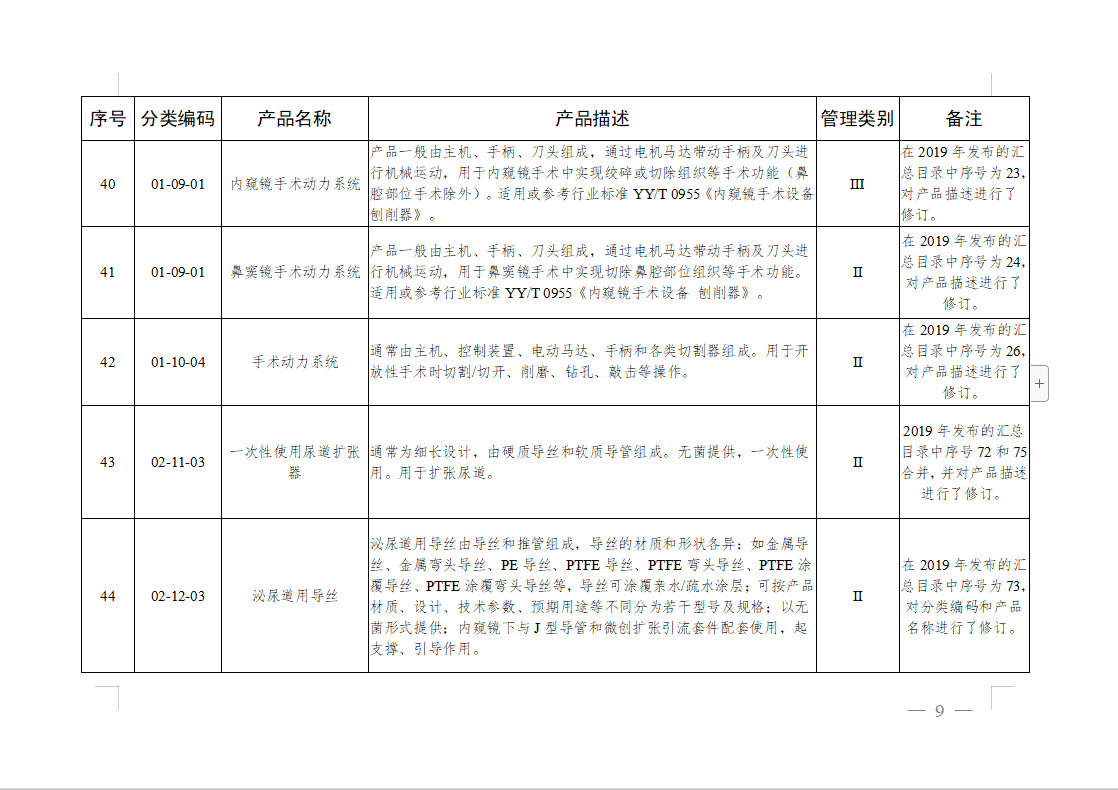
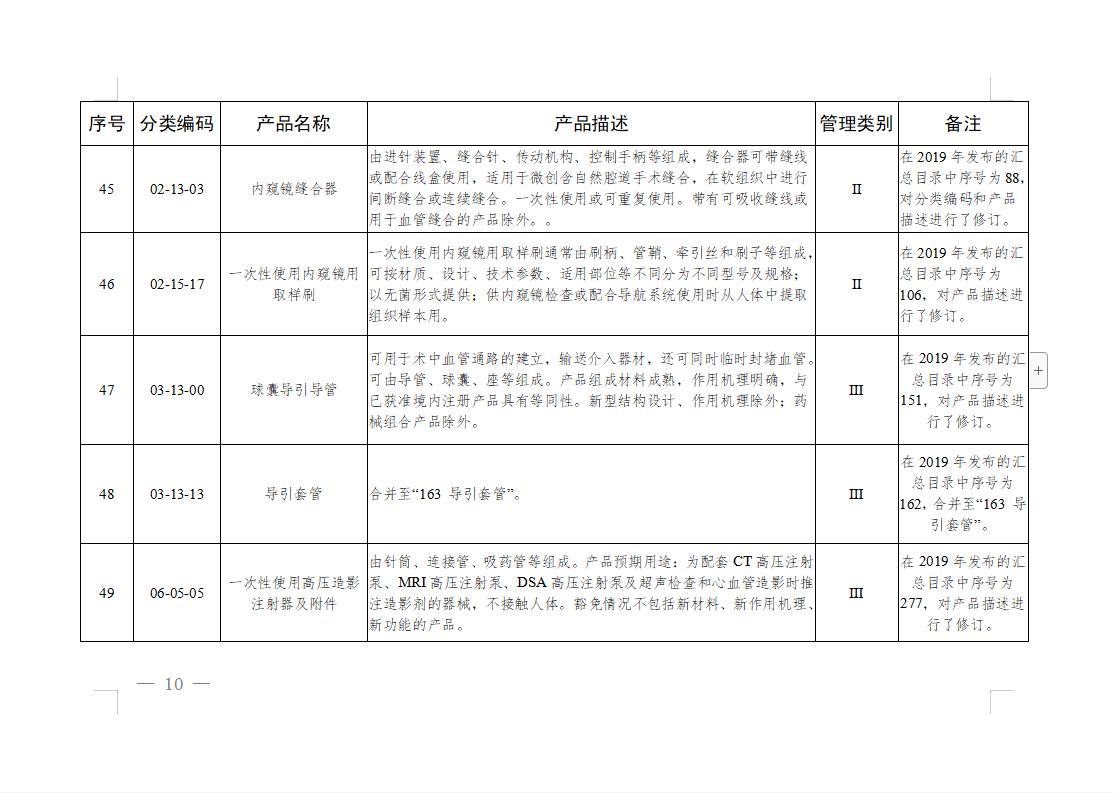
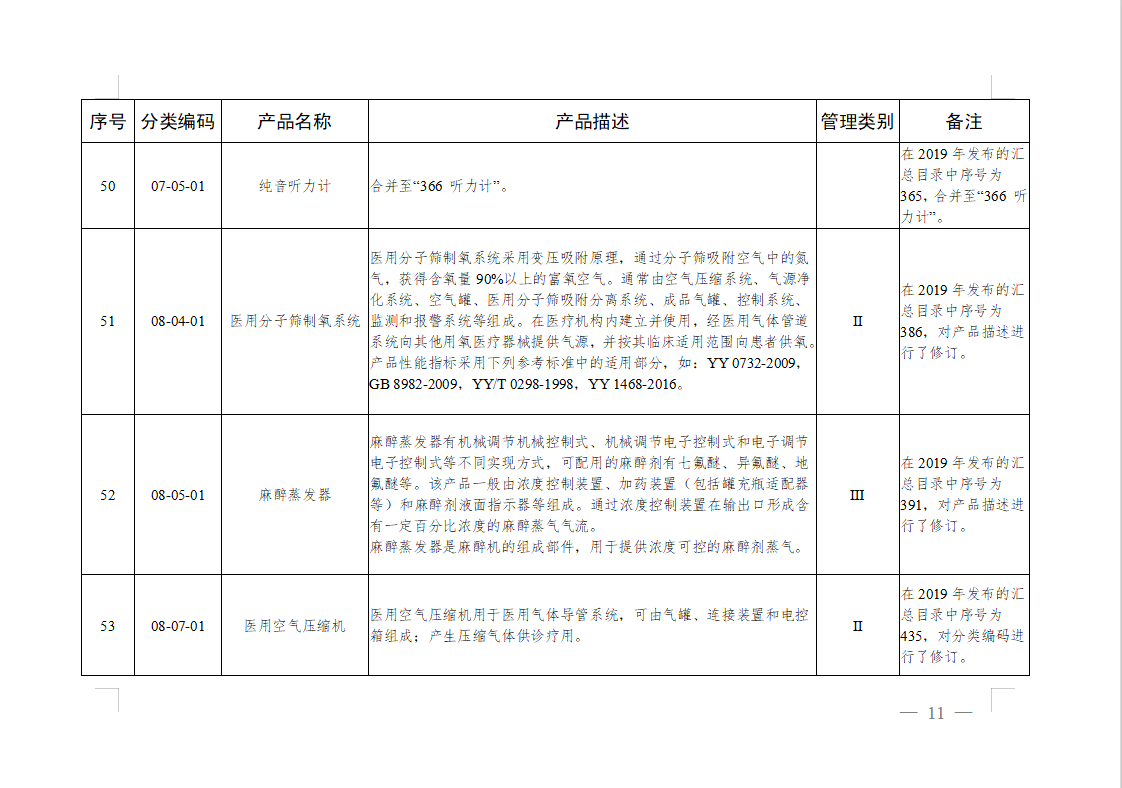
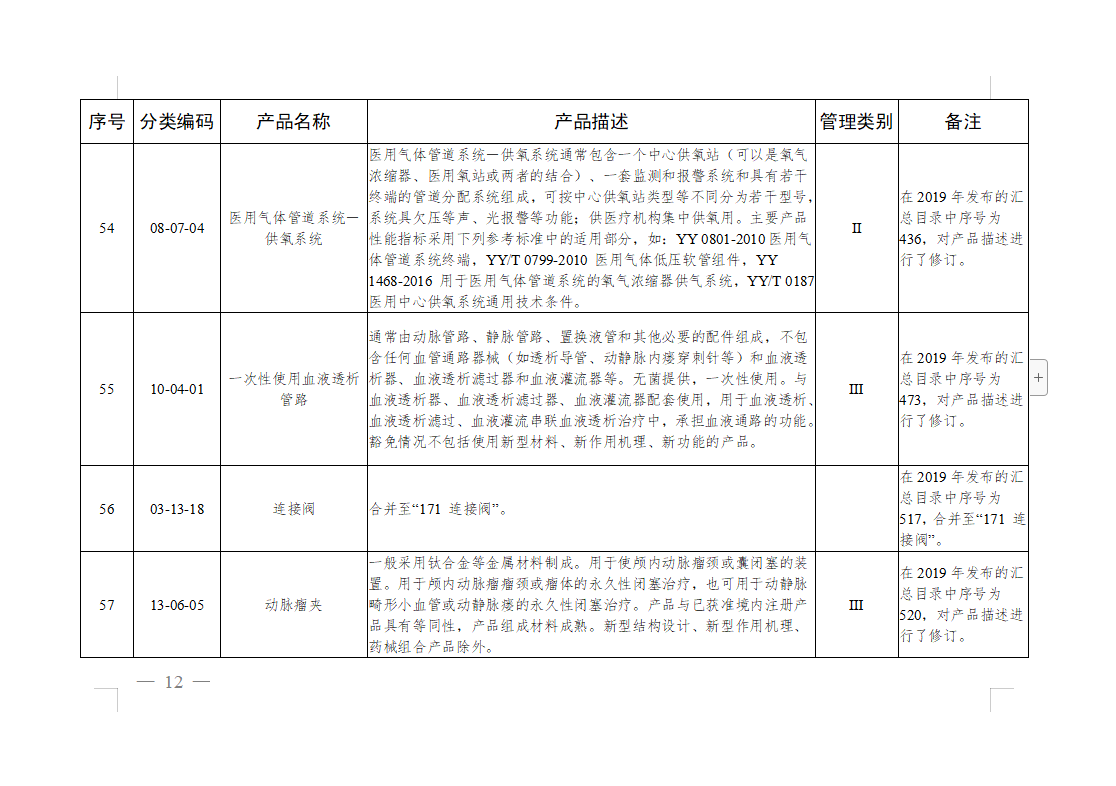
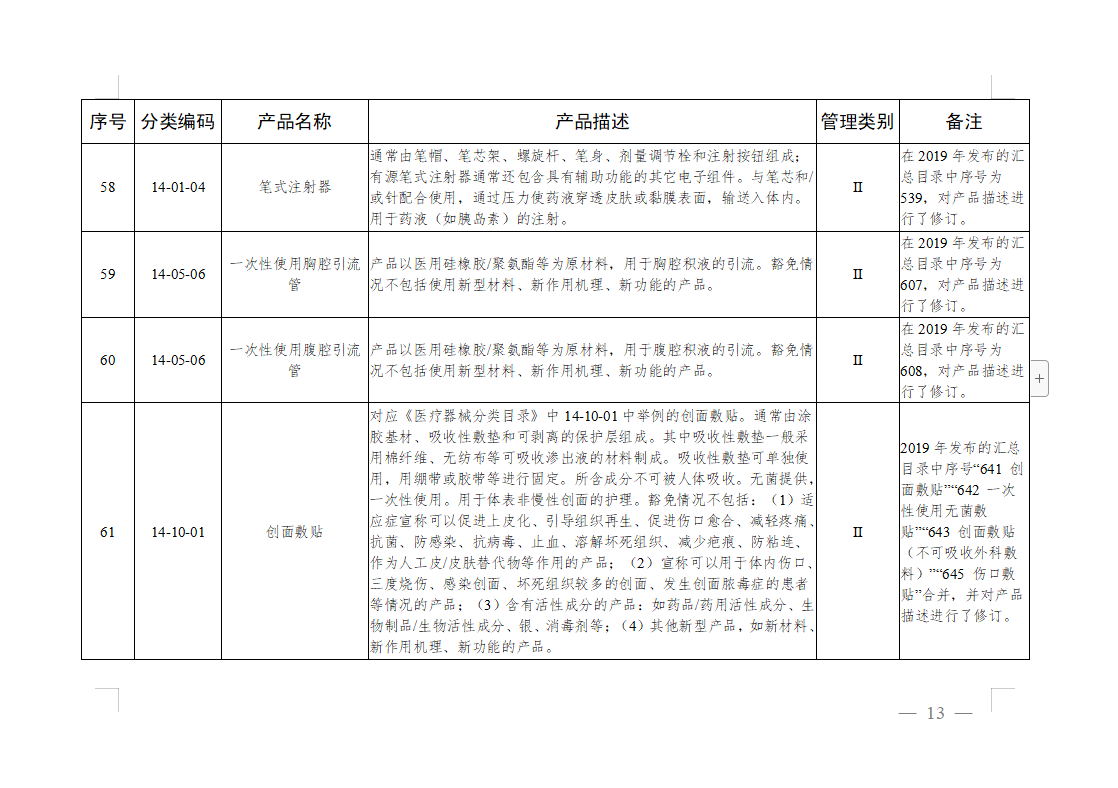
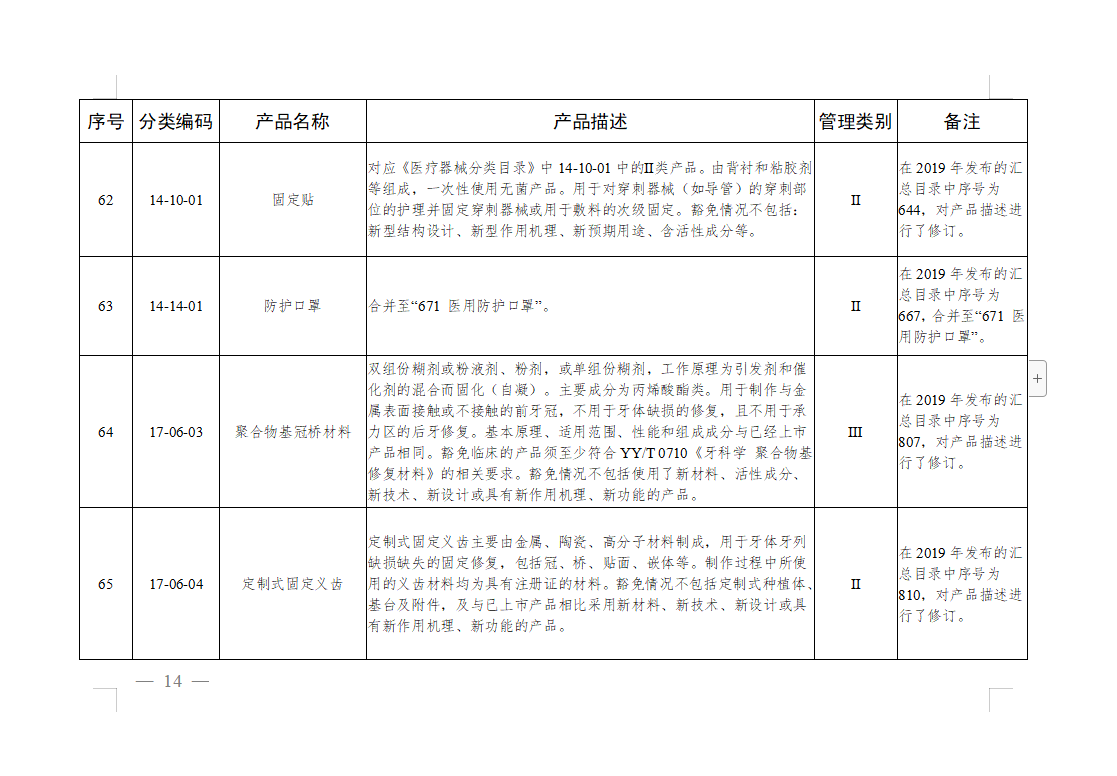
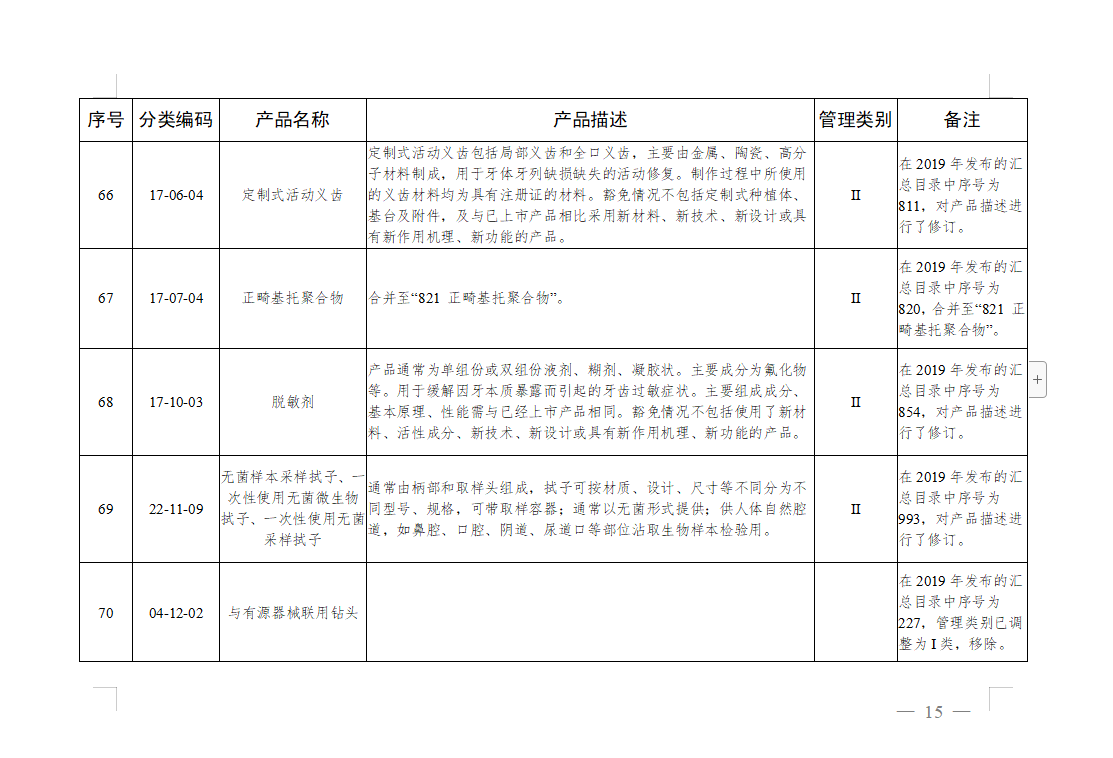
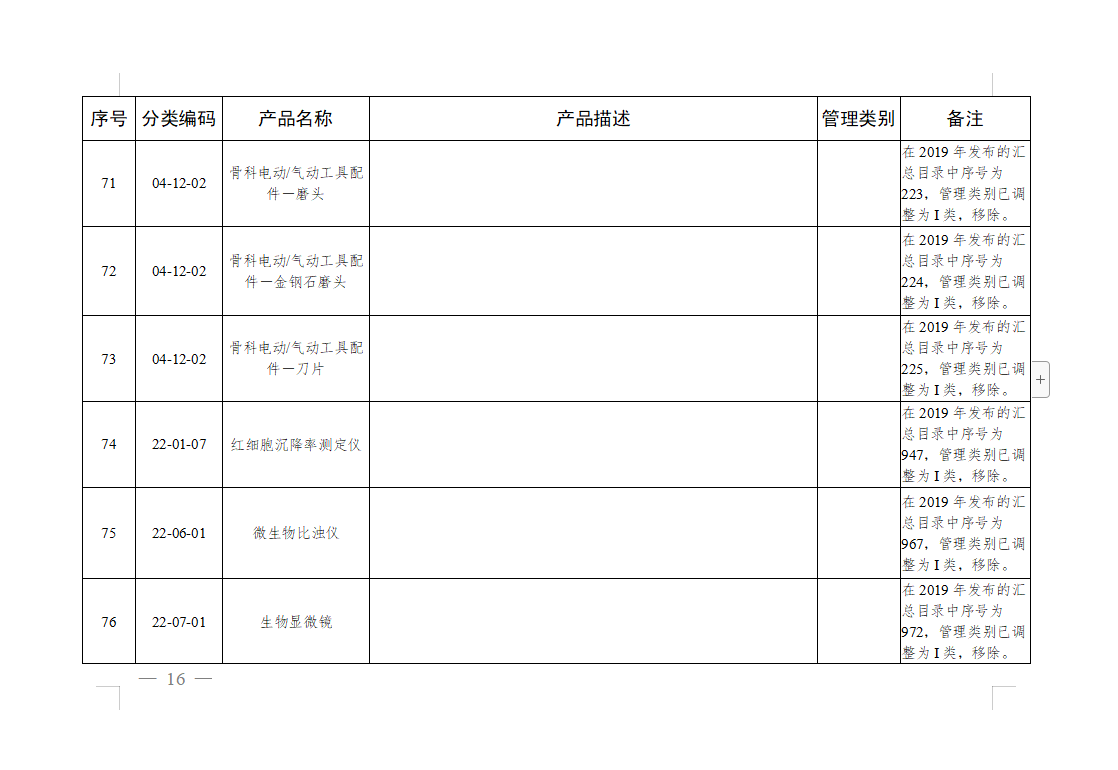
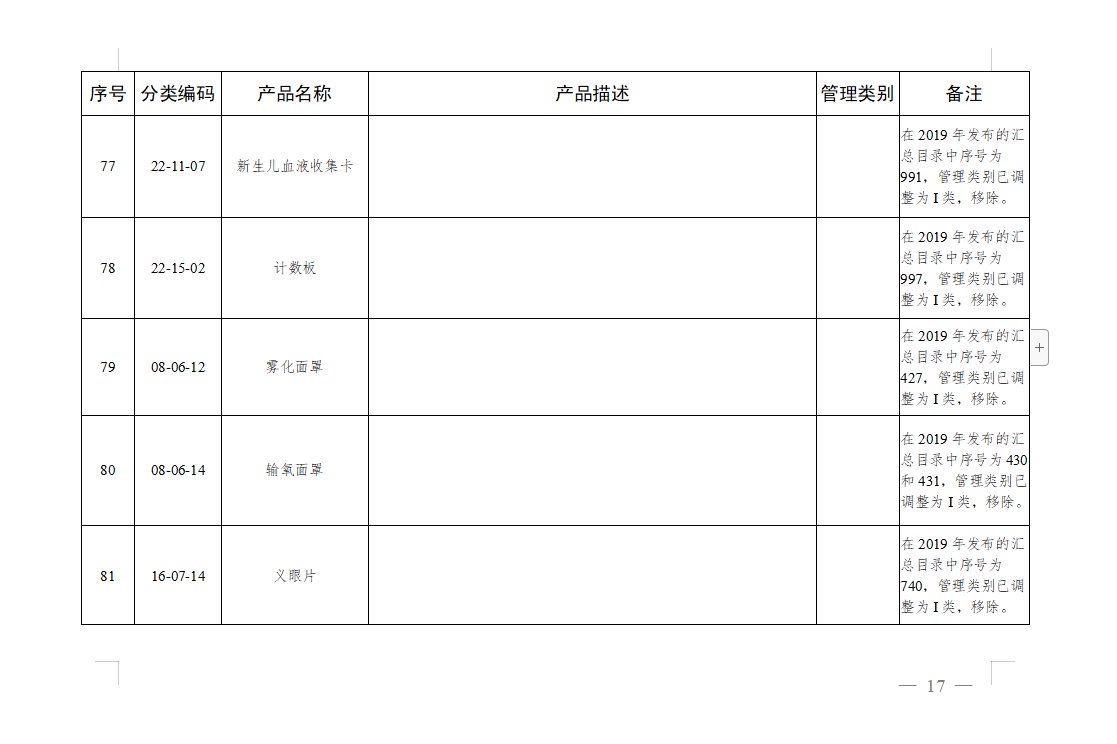
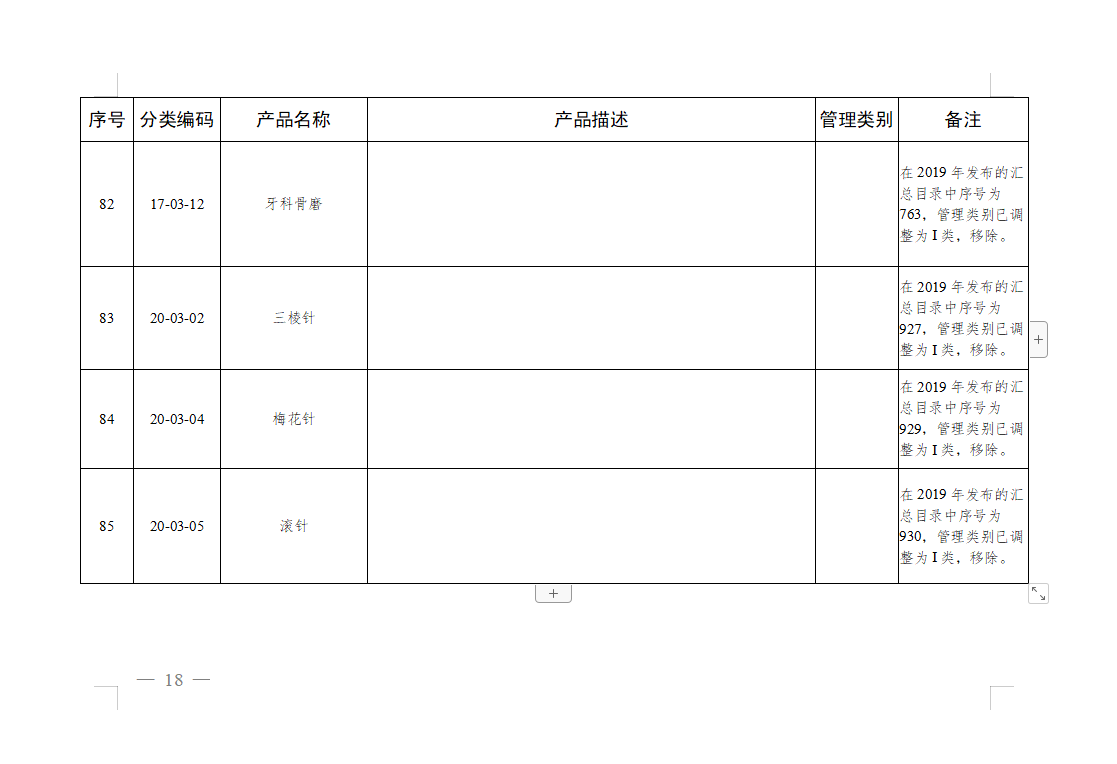
免于进行临床试验医疗器械目录:
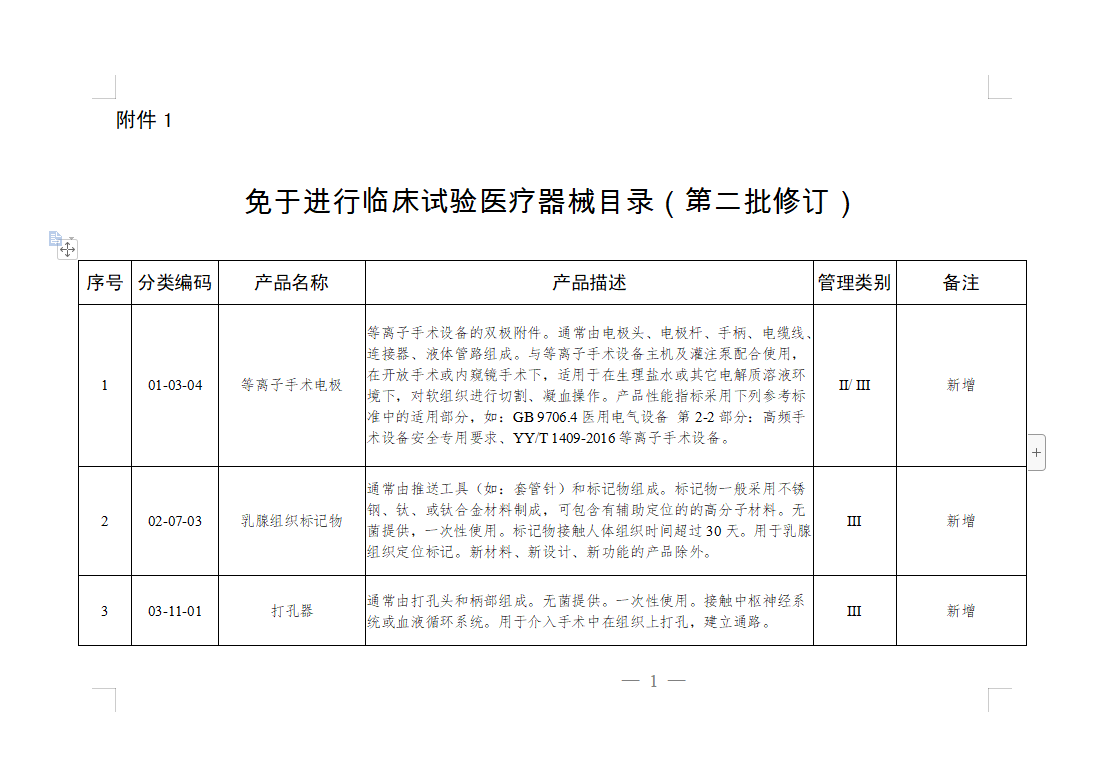
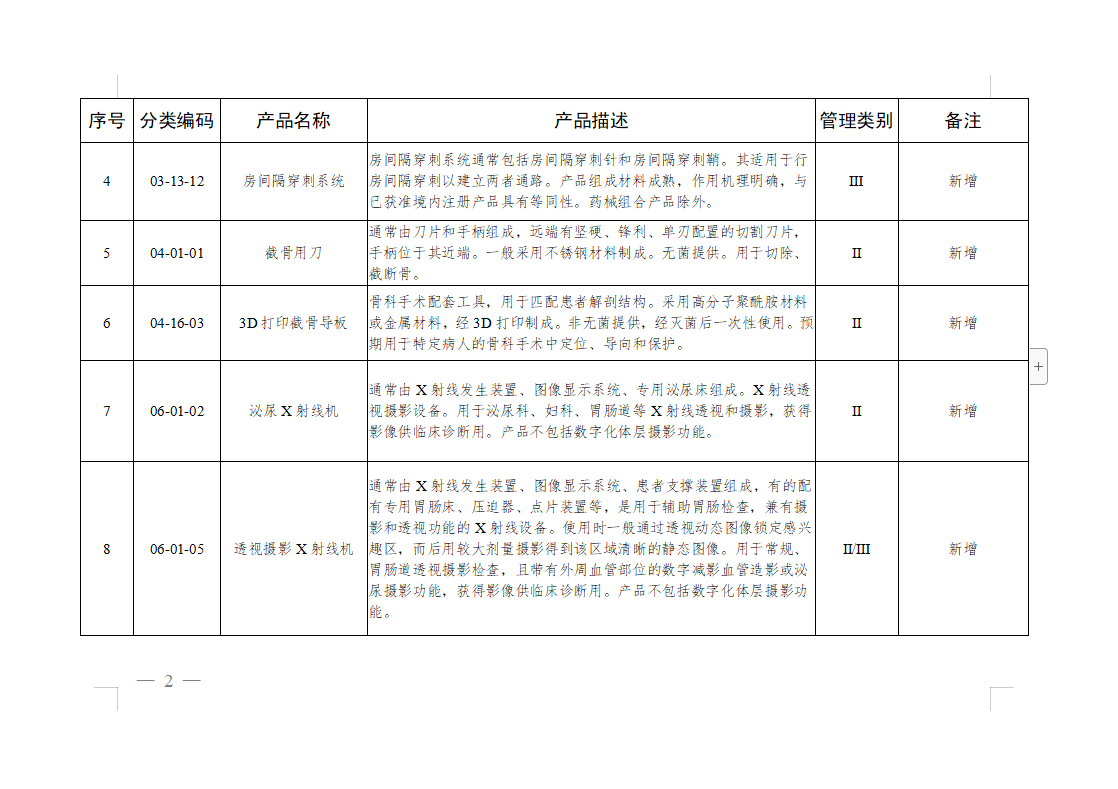
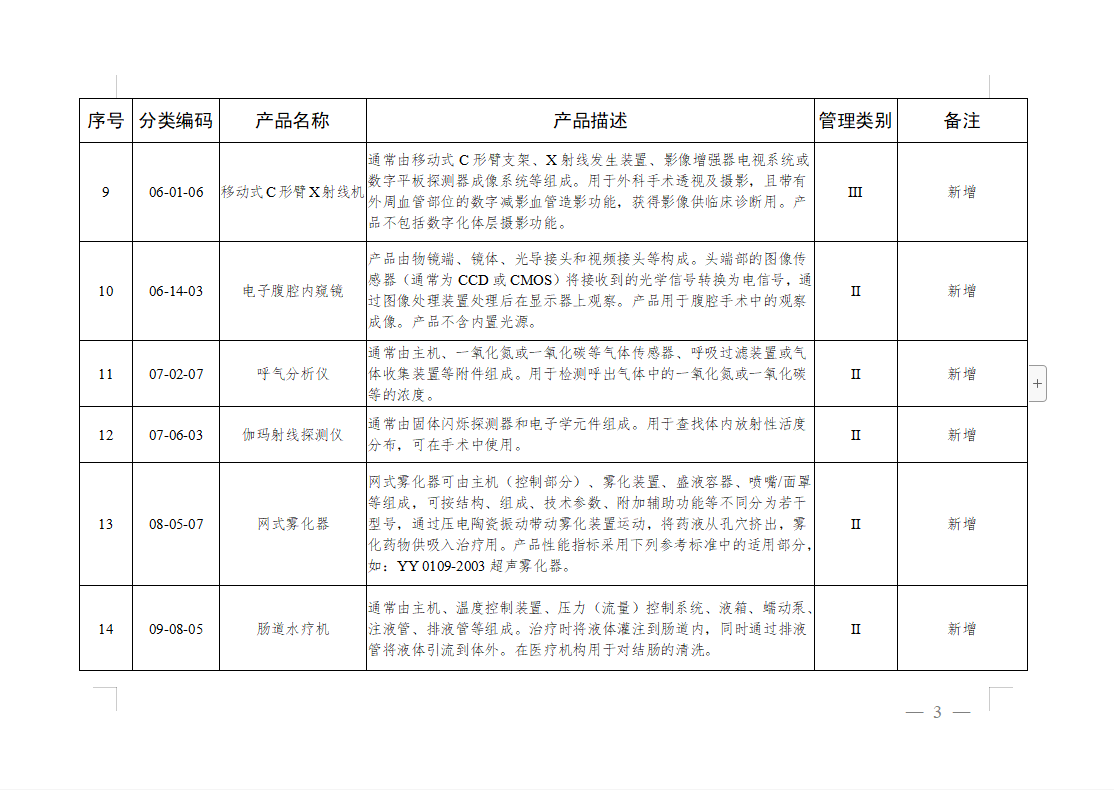
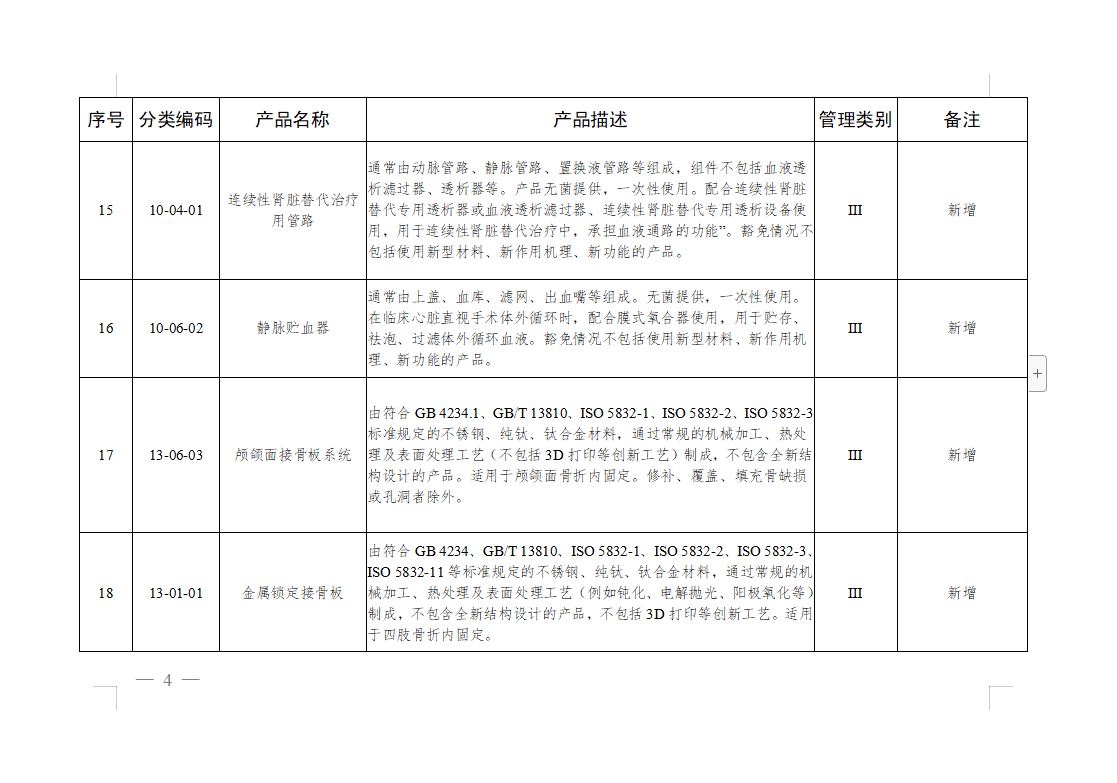
微珂咨询专业从事医疗器械法规及注册咨询服务,提供法规及标准的培训,具体服务领域包括:
一:欧盟认证(类似于注册):医疗器械欧盟CE认证咨询(MDR、IVDR)、ISO13485医疗器械体系认证咨询。
二:美国FDA注册(包括510K、QSR820等)
三:国内注册NMPA(临床方案CRO、产品注册证、生产许可证、进口注册)。