什么情况下可以豁免MDSAP认证审核?今天小编就在这里为大家进行一个解答!
eSTAR背景
2020年2月,为了支持仅以电子格式提供的上市前通知[510(k)]提交的过渡,CDRH开发并开始试行电子提交模板和资源(eSTAR)的使用。
2021年11月29日, FDA在官网上发布了eSTAR PDF Template,以供医疗器械提交者自愿使用。该模板通过标准化的格式,使提交者可以确保提交的内容完整,FDA可以更高效地进行审查。
目前,eSTAR已更新到版本2.0(2022年10月07日发布),并且只接受510(K)及De Novo的提交(如下图):

如何使用eSTAR提交文档
1)下载正确的 eSTAR PDF 模板并保存,然后再在 Adobe Acrobat Pro 中打开。
2)阅读、理解并按照 eSTAR PDF 模板中各个模块的介绍、密钥、常见问题解答和版本历史等,并按照相应说明进行操作。
3)填写eSTAR PDF 模板。该模板仅用于建立文件,而不是提交申请。模板末尾的说明提供了有关如何提交申请的说明。
eSTAR文件与eCopy的差别
eSTAR文档仍是建立在原先eCopy的基础上的,所需的内容基本一致,主要变化在于提交者无需在eSTAR中提供使用Indication for use页面(FDA 3881表格)、CDRH Premarket Review Submission Cover Sheet(FDA 3514表格)或符合性声明(如适用),因为所有这些都内置于eSTAR PDF中。此外,如果选择使用eSTAR创建510(k)摘要,则无需在eSTAR中提供额外的510(k)摘要。
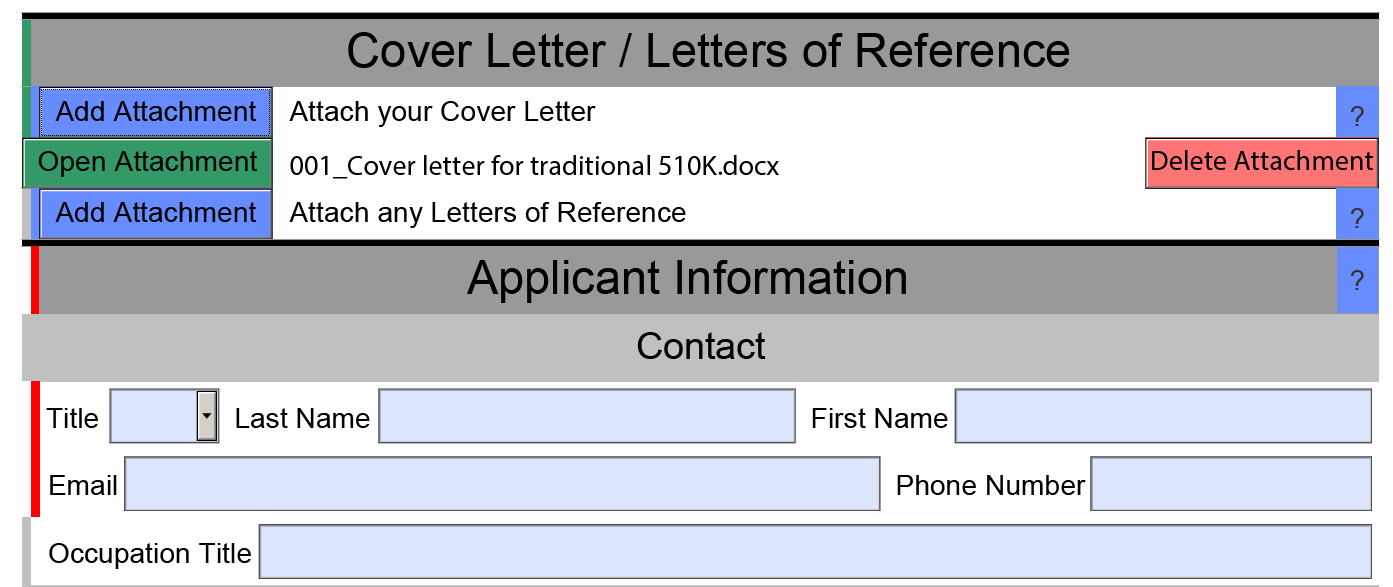
eSTAR文件的填写
目前的填写方式还是比较便捷的,各个模块右边的“?”图标中都对当前所需的文件有介绍和提示。
填完的部分在左边会显示为绿色,没填的为红色。针对不同性质的产品(如灭菌,有源等),在选择相关特性后整个模板也会做出相应的更新。正确完成eSTAR 文件后,顶部的状态消息会显示为“eSTAR Complete”。
eSTAR审核时长
在FDA收到eSTAR提交后,鉴于使用依据eSTAR PDF模板准备的提交文件应为完整的提交,预计eSTAR提交不会经过拒绝接受(RTA)程序。但是,FDA会对eSTAR采用病毒扫描和技术筛选过程。
FDA将在收到510(k)后60天内做出最终决定,但如果eSTAR提交时仍不完整,FDA将通过电子邮件通知提交者并识别不完整的信息,提交将被暂停180天或直到向FDA提交完整的替代eSTAR。
eSTAR运行时间
目前,使用eSTAR是自愿的。但是,自 2023 年 10 月 1 日起,所有的 510(k) 提交,除非是豁免产品,否则必须使用 eSTAR进行电子提交。