
IVDR的实施对整个行业和所有相关人员来说是一项非常具有挑战性的任务:利益相关者、欧盟委员会和成员国。确保患者获得安全有效的IVD是实施工作的重点。为了应对与实施IVDR有关的挑战,本文件重新评估了实施的优先事项,并提出了成员国和委员会服务的联合计划。
本文的主要目的是商定在短期内将有限的资源集中在何处,以确保在申请日期前尽快交付。本文件中规定的优先事项是基于公共卫生、患者安全和透明度的目标确定的,这些目标是新立法的关键,也是利益相关者最迫切的需求。
本联合实施计划是MDCG(包括相关小组)在利益相关者的参与下审查的结果。该计划已在2021年 5月28日的MDCG会议上原则上获得批准。除了确定优先事项外,该计划还将作为监测其执行情况的动态文件。各项行动的状态和时间规划将动态更新,以反映工作进展。
这些优先事项分为A、B两组:
l A组包括对设备进入市场至关重要的行动(那些与应急计划框架和公告机构的有效性有关的行动);
l B组包括法案和指导文件,虽然不是强制性的,但将极大地促进参与者的工作,以及指定欧盟高风险IVDs参考实验室。它们包括欧盟参考实验室的指定、通用规范、若干主题和标准的指导。
对于A组和B组,确定了列为优先级别的行动列表。其中我们筛选了正在进行或者将要进行的部分,与大家分享。
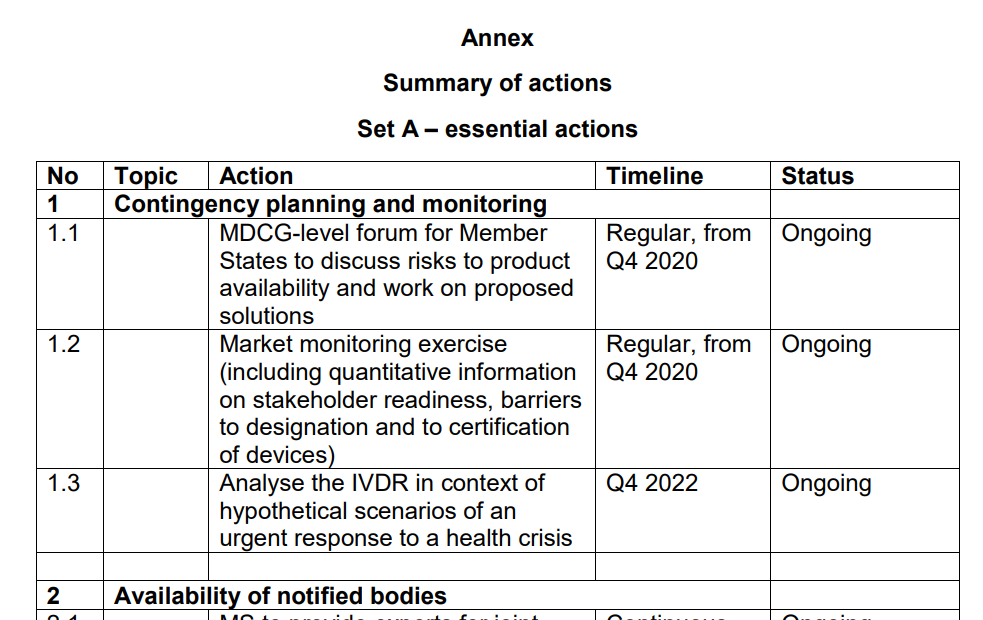
A组
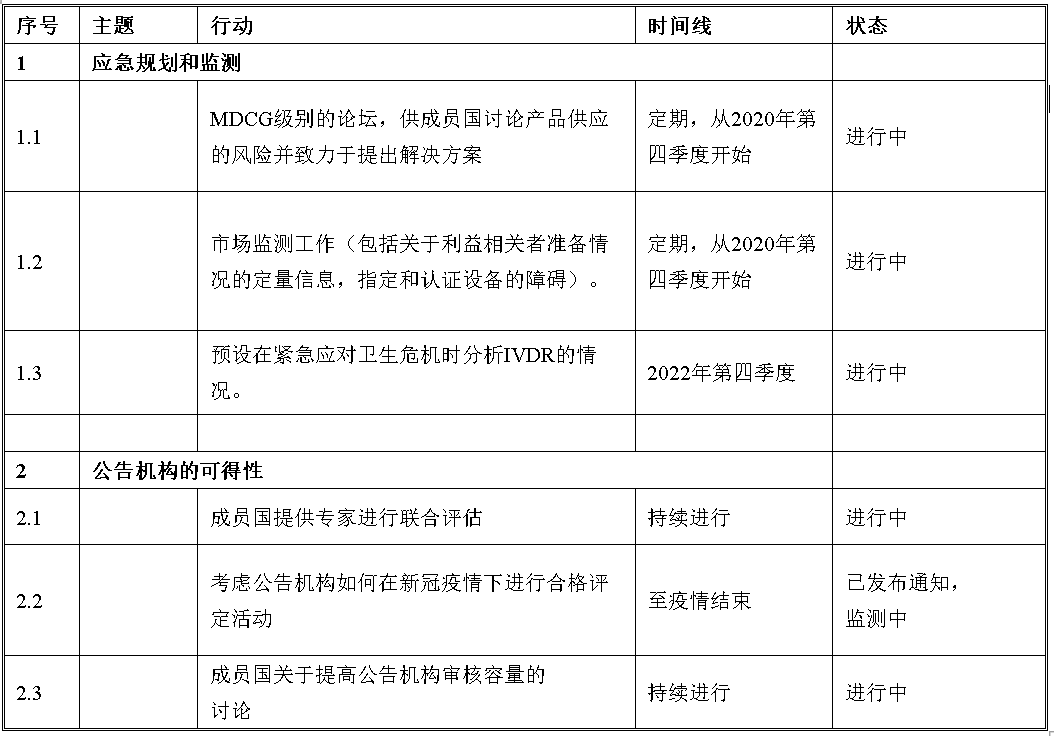
B组
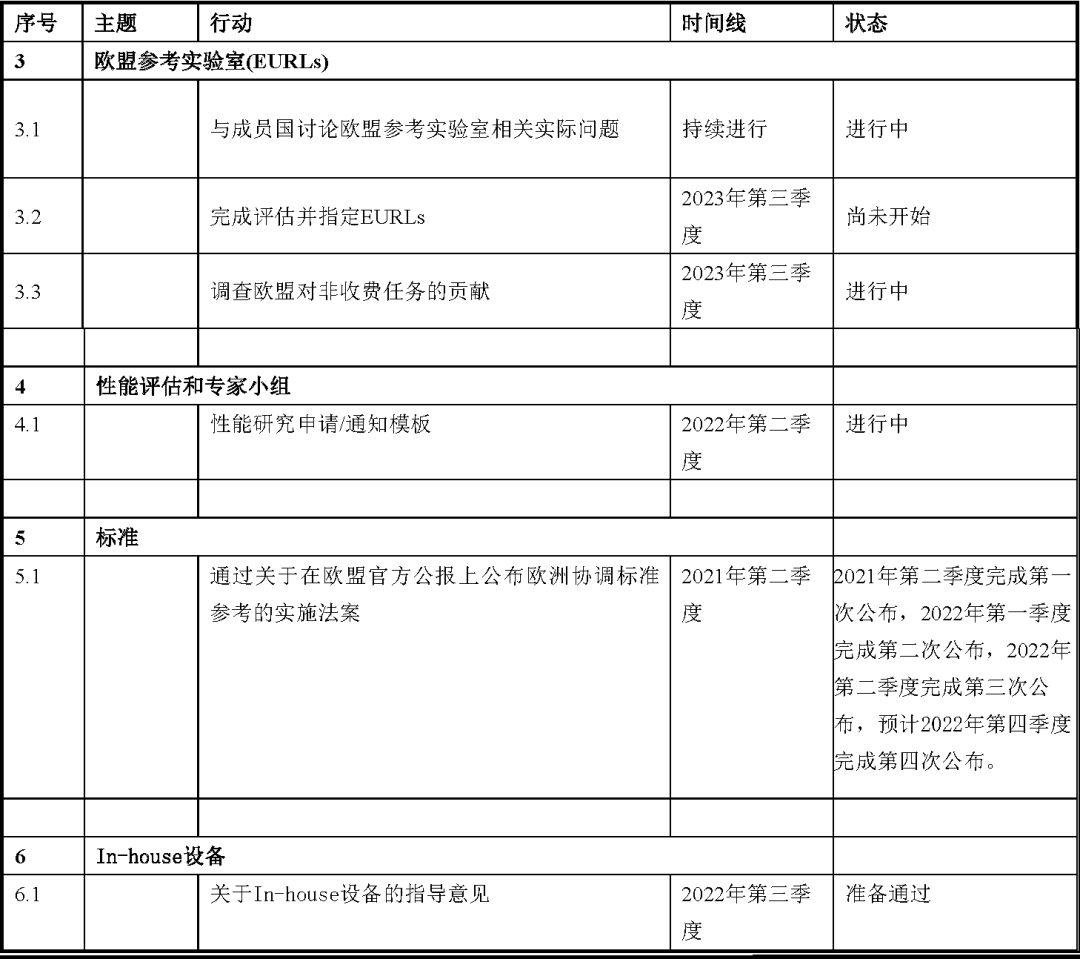
从上我们可以看到应对IVD认证产品供应的风险,以及可能出现的公共卫生危机情况,关于提升公告机构审评产能的讨论将会持续进行。在欧盟的官方公报上,更多的欧盟协调标准将会公布。欧盟高风险IVDs参考实验室的评定正在进行。
微珂将持续关注IVDR实施推进的动态,助力企业实施欧盟市场战略。