MDR认证法规下的验证与确认实施及追溯分析
实施
风险管理以设计输入要求的开发开始。随着设计的进展,新风险可能会变得明显。为了系统
地识别并在必要时降低这些风险,将风险管理过程整合到设计过程中。通过这种方法,如果变更
更易于制作并且成本较低,可以在设计过程的早期识别和管理不可接受的风险。
例如
一个将曝光控制系统用于通用x射线系统: 如果将控制功能分配给软件,在开发过程后期,
系统的风险分析揭示了可能导致患者过度暴露的几种失效模式。由于在设计接近完成之前尚未识
别到问题,因此必须添加昂贵且独立的备用计时器来监控曝光时间。
1.基于风险分析、法规、标准、客户需求、通用规格等形成完整的需求规格。
2.设计
3.实施设计验证及设计确认
以无菌屏障系统验证和确认为例:
1. 用户的需求
●无菌保障水平10-6
●产品的货架寿命5年
●如何实现:(识别所要遵从的EN标准、ISO标准或者其他标准)
●通过原材料的清洗、在洁净环境中生产控制初始污染菌。
●采用最终产品灭菌。
●选择质量与灭菌工艺匹配的包装材料。
●选择合适的密封工艺
2. 设计验证:
●初始污染菌的检测;
●包装材料的来料检验;
●热合后包装密封强度、染色液渗透、外观检测;
●无菌包装老化后包装性能检验;
●产品老化后性能检验 (无菌、灭菌剂残留、热原、内毒素和热原等)
3.设计确认:
●通过分析原材料初始污染菌、包装材料初始污染菌、热合后的包装性能、灭菌及老化后的包装性能、老化后的包装性能及产品性能结果、热合工艺验证结果、灭菌工艺验证结果、制造环境监测结果等确认在规定的制造环境和工艺下,采用经验证的原材料可持续的生产出满足用户需求的产品。(仅指无菌屏障能力满足用户需求,无菌保障水平10-6,货架寿命5年)。
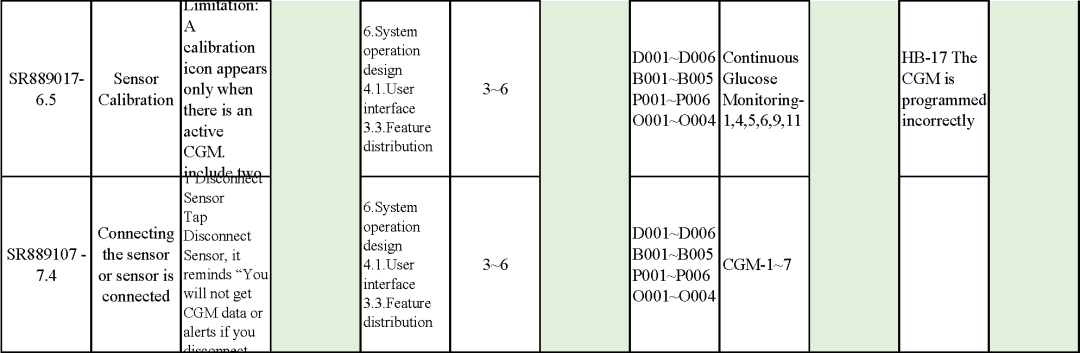
追溯分析
确保需求都已实现、产品满足客户需求或者其预期用途
追溯示例
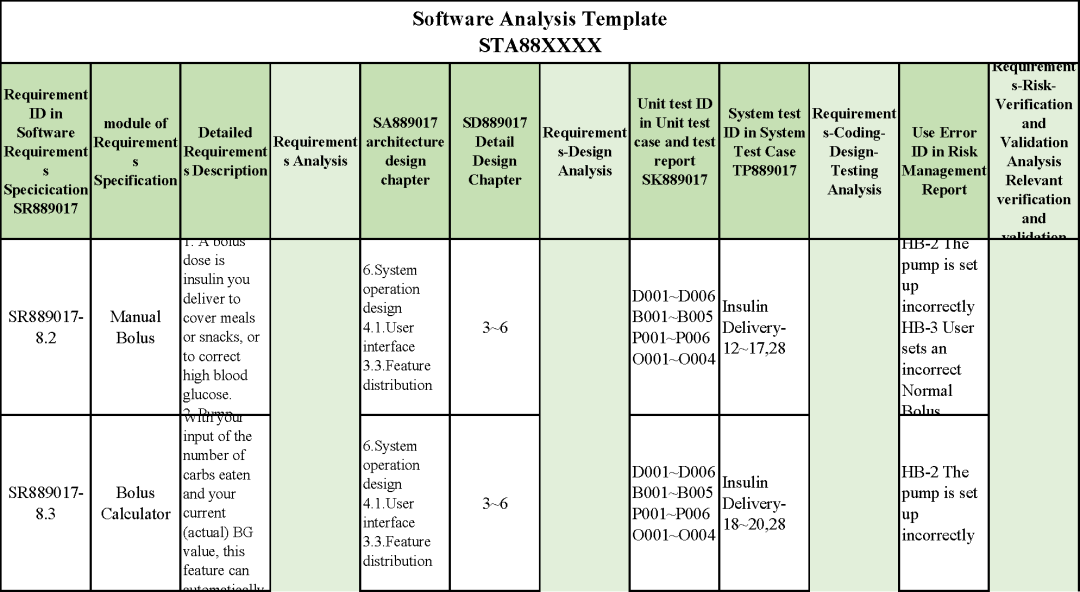
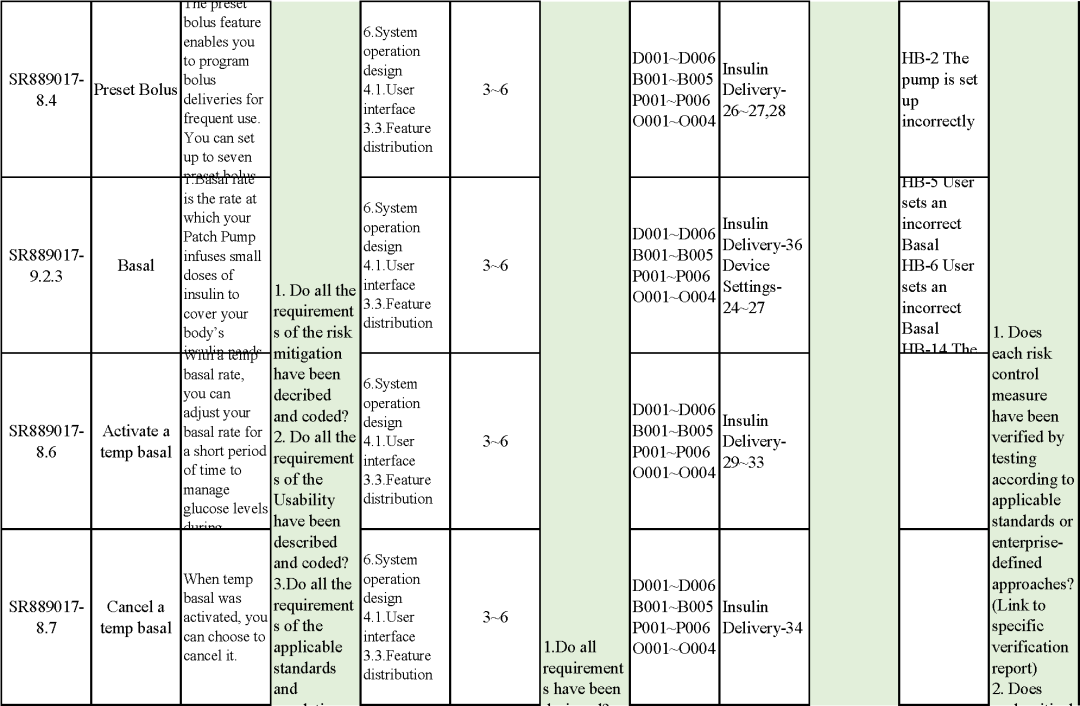
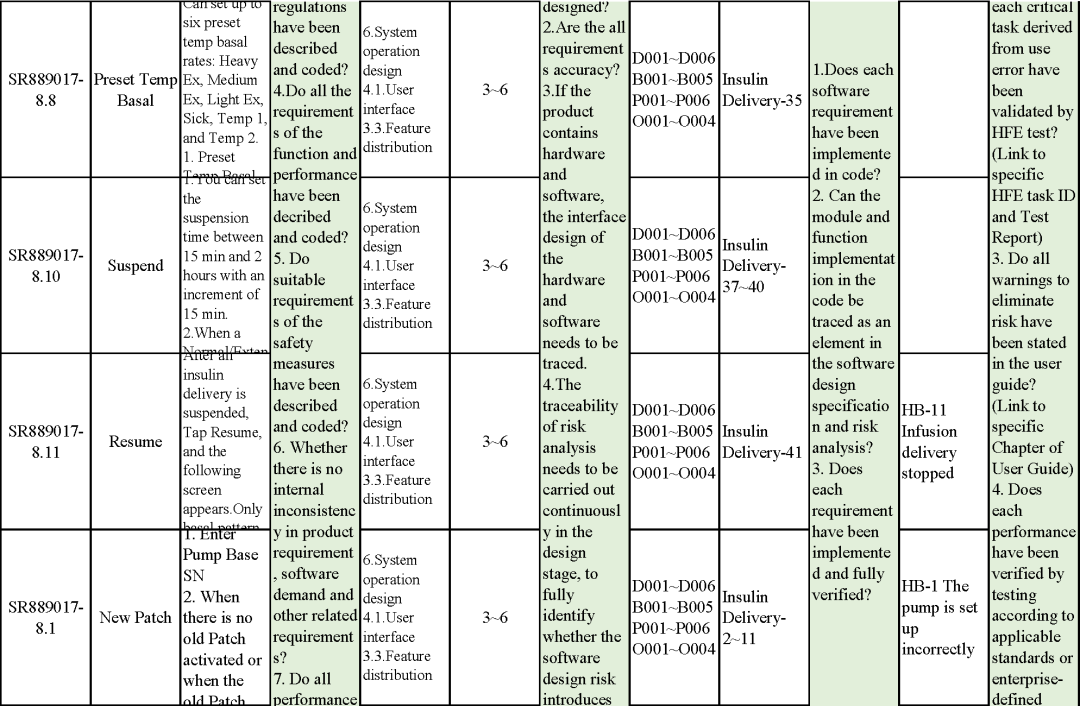
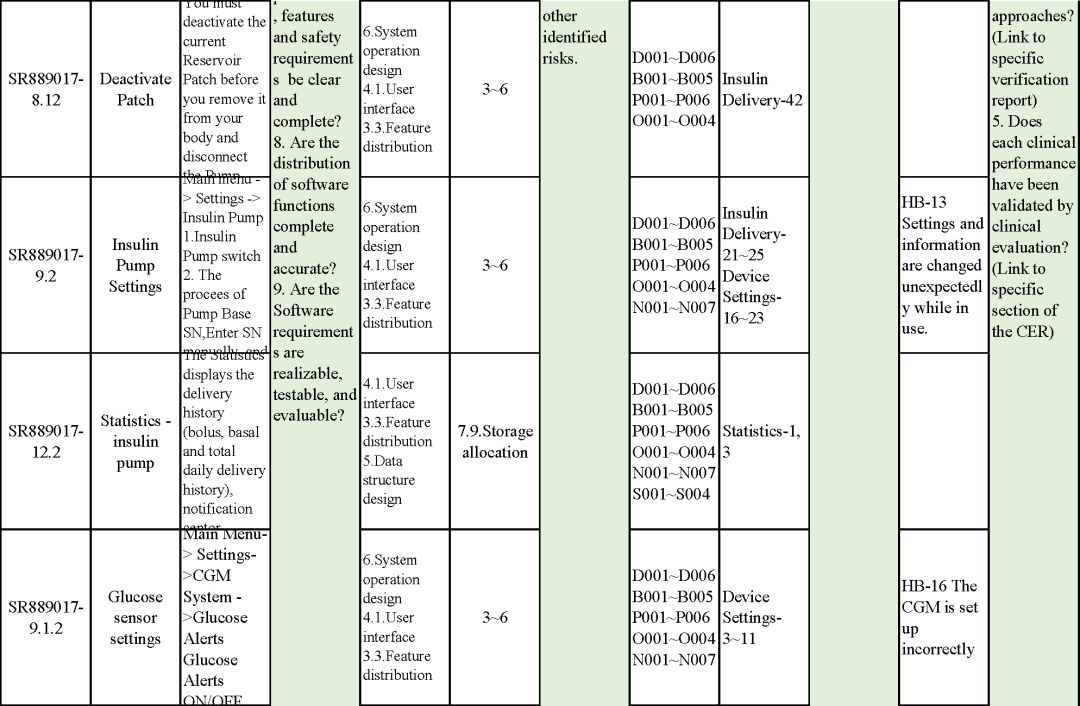
微珂提供专业的MDR/IVDR认证服务,欢迎来电咨询:
微珂医药拥有海内外专业成熟的技术团队、以及与机构深度的战略合作,服务于医疗器械企业,为企业提供优质的定制化服务,协助企业从产品技术要求编写、产品检测、临床评价资料编写与审核、申报与跟踪,根据企业实际情况,进行质量管理体系建立,帮忙企业从管理到产品各环节一站式服务!
微珂集团服务热线:400-118-2826!