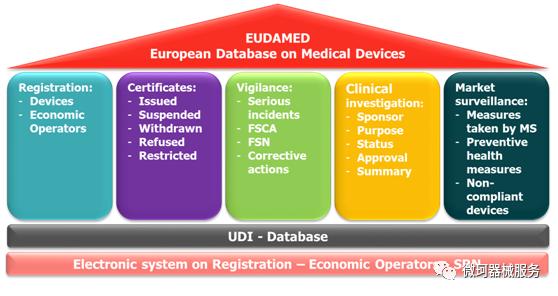
MDR新进程_EUDAMED首个模块即将投入使用
根据MDR第 30 条,所述的经济运营商电子登记系统。EUDAMED将提高欧盟市场上有关医疗器械的信息的透明度和协调性。
根据MDR的规定,理论上包括制造商、经销商和欧代在内的所有经营者都应当在Eudamed中进行注册并及时更新资料。
原定于2020年3月28日上线的Eudamed欧盟数据库已延迟至今,据悉,第一个模块即将于2020年12月1日起上线。
根据MDR,企业在向公告机构申请MDR时就需要在EUDAMED注册后获得的SRN(单一注册号)。而对于境外制造商,在申请SRN代码时,必须指定本地用户管理员LUA( Local UserAdministrator)。该用户管理员可从主管部门处获得数据库链接。
一个组织的每个参与角色都需要一个SRN代码。即使一个制造商有多个生产地点,作为制造职能,多个点也仍然只需要一个SRN代码,除非这些地点在不同法定制造商的标签(及证书、IFU等)上面被标出来。欧代AR,虽然是同时作为n家制造商的欧代,但其职能是一样的,又是一个组织,所以可以申请一个SRN。
微珂医药技术服务有限公司作为医疗器械注册法规第一线的技术服务公司,提供欧盟CE-MDR/IVDR技术咨询,美国FDA注册、国内注册NMPA注册、ISO13485体系认证咨询、欧盟/美国授权代表、等医疗器械行业技术咨询服务。为企业产品出口欧盟保驾护航!