冬日可爱,喜讯传来,今日从EUDAMED传来喜讯,我司合作客户的Class III类器械已顺利获得TUV南德颁发的欧盟CE-MDR证书,这不仅是国际市场对该器械符合欧盟法规安全性和有效性的充分肯定,也标志着该产品成功拿到了欧洲市场的“准入证”,为其进一步打开国际市场奠定了基础,制造商可顺利进军海外市场,推进产品成功进入欧盟市场。

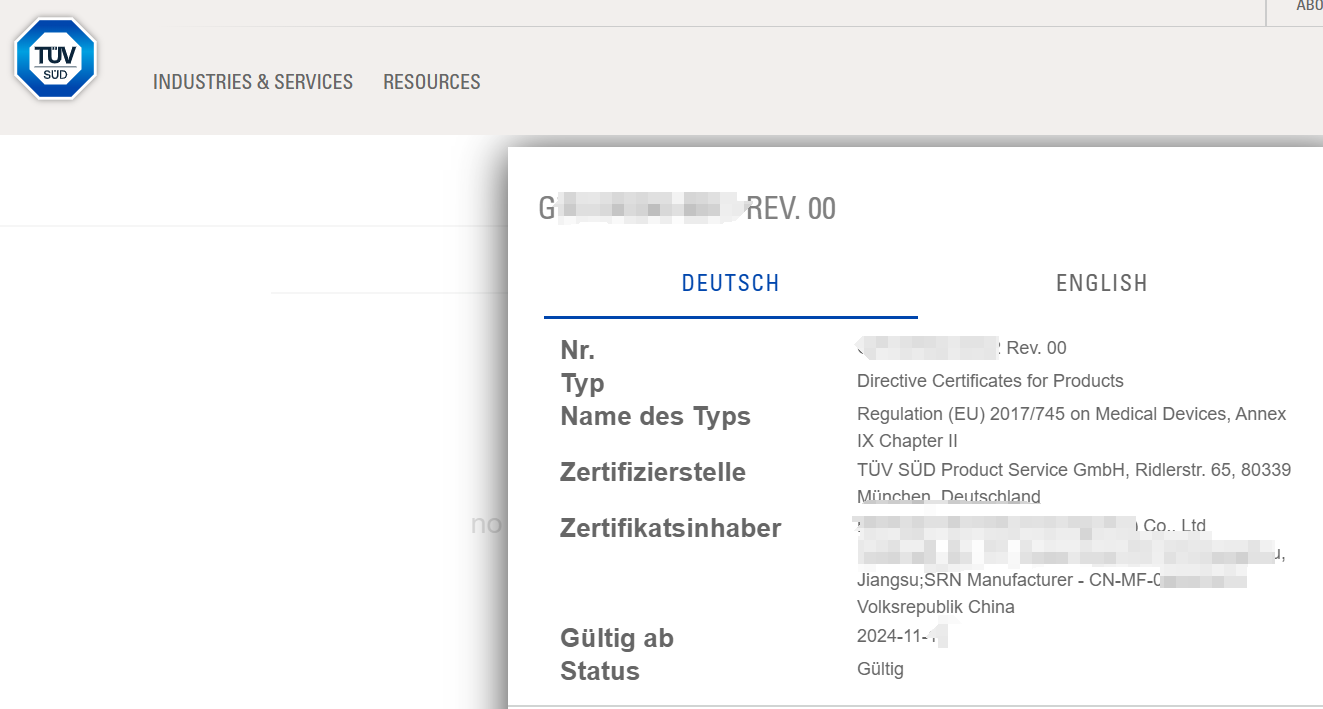
CE-MDR证书是欧洲共同体颁发的产品质量标志,它不仅是对产品安全性和符合性的一种认证,更是打开欧洲市场大门的重要通行证。本次顺利获得MDR,离不开企业和微珂的精诚合作,彼此信任,充分体现了微珂医疗陪伴式服务的优势;也离不开制造商医疗团队的坚持不懈和对卓越品质的不懈追求。在产品研发过程中,企业医疗器械严格按照欧盟的相关指令和标准进行设计和生产,确保了产品的安全性、有效性和可靠性。
微珂服务集团(Microkn)可提供的MDR认证咨询的相关服务有:MDR法规下CE技术文档建立,MDR法规下临床评价及整改,MDR法规下质量管理体系辅导,以及一系列专业的培训和技术服务,整个项目进程和服务受到了制造商的高度认可。该III类器械也是由微珂参与辅导的多个III类MDR项目,是心血管、骨科、可吸收植入物等高风险领域后,在自交联和生物医用材料类的获证项目。同时也要感谢公告机构的审核专家,他们通过敬业和严谨的工作,以及迅捷的项目管理和发证速度,为中国医疗器械企业助力护航,推动企业产品在国际市场布局和发展的“快车道”。