四月最美,春暖花开,捷报频传,喜讯不断!2024年4月初,从公告机构TUV莱茵传来喜讯,有微珂全程辅导的IIa类理疗医疗器械顺利获得CE-MDR批准上市,标志着该产品在CE认证适用国家正式迈入商用阶段,制造商可顺利进军海外市场,推进产品全球化上市。
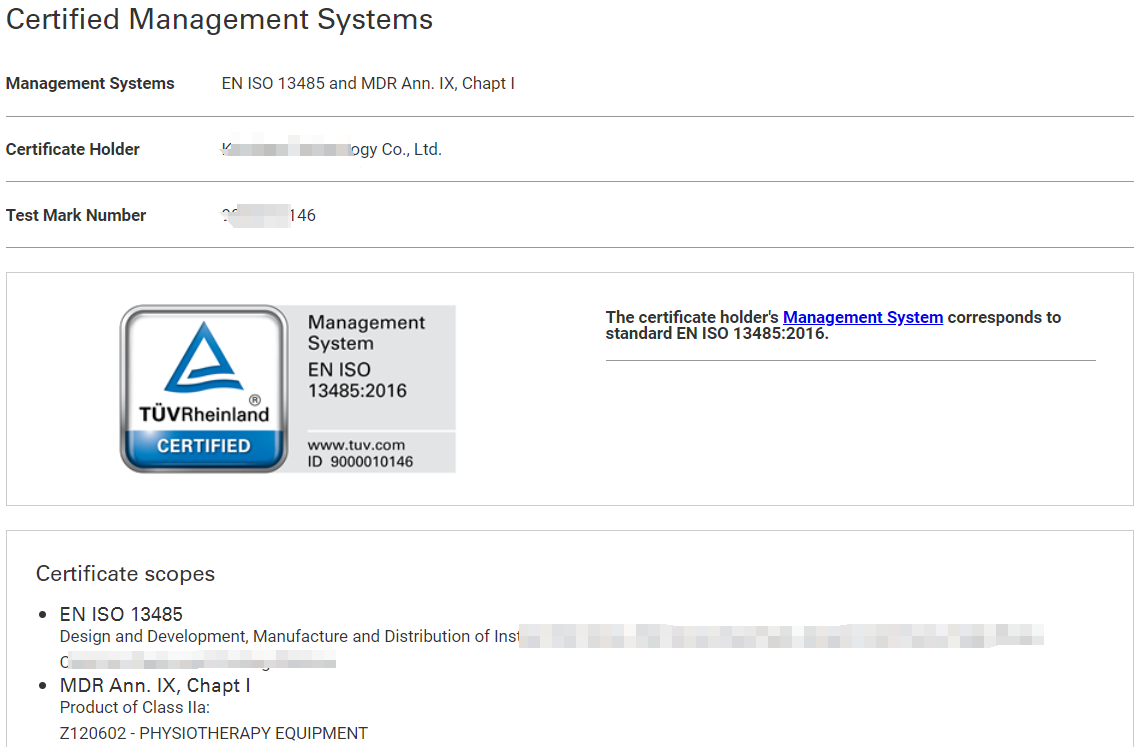
CE-MDR证书是欧洲共同体颁发的产品质量标志,它不仅是对产品安全性和符合性的一种认证,更是打开欧洲市场大门的重要通行证。
微珂咨询(Microkn)可提供的MDR认证咨询的相关服务有:MDR法规下CE技术文档建立,MDR法规下临床评价及整改,MDR法规下质量管理体系辅导,以及一系列专业的培训和技术服务,整个项目进程和服务受到了制造商的高度认可。
在本项目中,微珂全程参与了该项目的咨询工作,重点包括培训、文件制修订、模拟审核等。微珂与制造商首先就产品功能和性能深入分析,结合法规深入逐项进行临床评价、风险管理、质量管理体系等重点工作,讨论确定设计临床评价方案和临床文献检索方案,结合上市后不良事件和临床数据中的安全事件更新风险分析,使用SOTA数据和等同器械的文献数据支持满足器械的临床评价终点。基于对MDR法规及产品有深入的理解和分析,在临床评价(等同对比、文献检索、文献评估、临床数据分析)能够更准确的输出。通过丰富高效的服务流程,大大提高项目实施效率,针对临床评价、风险管理等这些专题,充分识别要求,直接高效的给出解决方案,项目得以顺利的提交、审核、整改、获得证书。
微珂咨询(Microkn)资深技术团队与制造商项目组密切配合,经过双方共同的不懈努力,接受了公告机构TUV莱茵审核团队及临床评审专家团队的严格审核,最终顺利通过MDR认证。在本次辅导项目中,微珂技术团队展现出扎实的法规能力,敏锐的合规意识,针对项目期间的发补和整改方向进行专项突破,步步为营,最终顺利通过TUV莱茵机构审核并取得MDR法规下CE证书,可喜可贺!
该项目的顺利进行,充分体现了微珂项目组定制式服务的优势,通过项目组和制造商团队的精诚合作,最终产品顺利获得CE MDR认证。经过这个项目的全流程后,微珂的团队对于承接理疗类CE MDR项目更具信心了。同时也要感谢TUV莱茵公司审核专家,他们通过敬业和严谨的工作,以及迅捷的项目管理和发证速度,为中国医疗器械企业助力护航,迈出了敲开欧盟国际市场大门的坚实一步。