近日,喜讯连连,由微珂咨询牵头并共同参与的项目从FDA接受资料开始评审到批准,前后62天,一次性通过。
新年新希望,喜报连连到。20242月最后一周,从FDA官网获悉,由微珂作为咨询公司助力的越凡医疗公司经皮神经电刺激器Transcuataneous electrical nerve stimulation(简称TENS)项目成功获美国食品药品监督管理局(FDA)510k批准,意味着该产品可以在美国市场合法经销。
宁波越凡医疗科技有限公司(WAT Med)是一家致力于创新个人用医疗设备的制造商。核心团队由多名海外专家组成,是宁波市“3315”计划重点引进的海外创新创业团队。

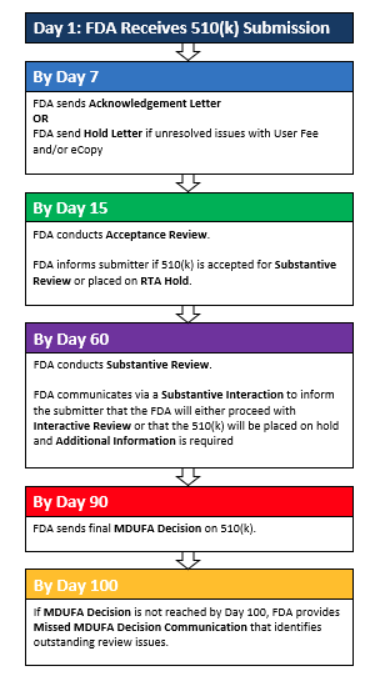
什么是FDA-510k ?
FDA-510K,是美国食品、药品和化妆品(FD&C)行动委员会的一个法案章节,而这个法案的章节,正好是在美国FD&C Act第510章节,所以很多人习惯性的把他称作是510K,而且这个是美国食品、药品和化妆品(FD&C)行动委员会法案,所以大家又都喜欢叫它做FDA510K,这就是所谓的FDA510K的由来。
因为根据这个510K章节的法案要求,凡是把一些规定的器械引入美国市场,都要求满足这个法案,那些不豁免510k的I类或II类或III类医疗器械,都必须做“产品上市登记”。所以这个产品上市登记,就是通常我们称做的FDA510(K)注册。
微珂服务集团,成立九年,致力和引领医疗器械注册服务、法规咨询、质量体系、测试等各领域,已形成医疗器械企业提供一站式、深入、全面、定制式技术咨询服务。
本次项目的顺利完成背后离不开双方亲密无间的默契合作,感谢制造商项目组全体成员高度重视和高效配合,加上微珂咨询高效优质负责的法规服务,双方协力齐心,共创佳绩。最终助力制造商成功迈出了敲开美国国际市场大门的坚实一步。
微珂将协助您完成FDA及510k的全程辅导,并让您的产品最终获得美国FDA的批准,获得进入美国市场的入场券。