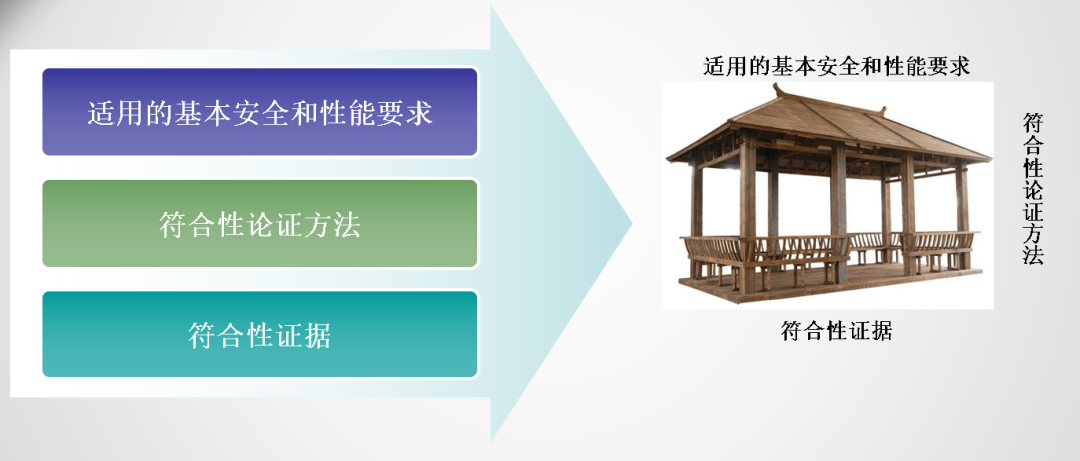
欧盟MDR认证新法规下:通用安全和性能要求
►基本要求( Essential Requirements) =>通用安全和性能要求( General safety and performance requirements)
►MDD 13条=>MDR 23条,8页增加到20页。
► Chapter I 总要求:1~9 ØChapter II 设计和制造的要求:10~22
- 化学、物理和生物要求,感染和微生物污染,含有药物、生物来源材料
- 结构和与环境的相互作用
- 带诊断和测量功能,辐射防护,电子可编程系统
- 有源器械及相连接器械,有源植入器械
- 机械和热风险防护
- 防护提供能量和物质的器械对病人和使用者的风险
- 器械预期由外行人员使用的风险防护
►Chapter III 器械提供的信息的要求:23
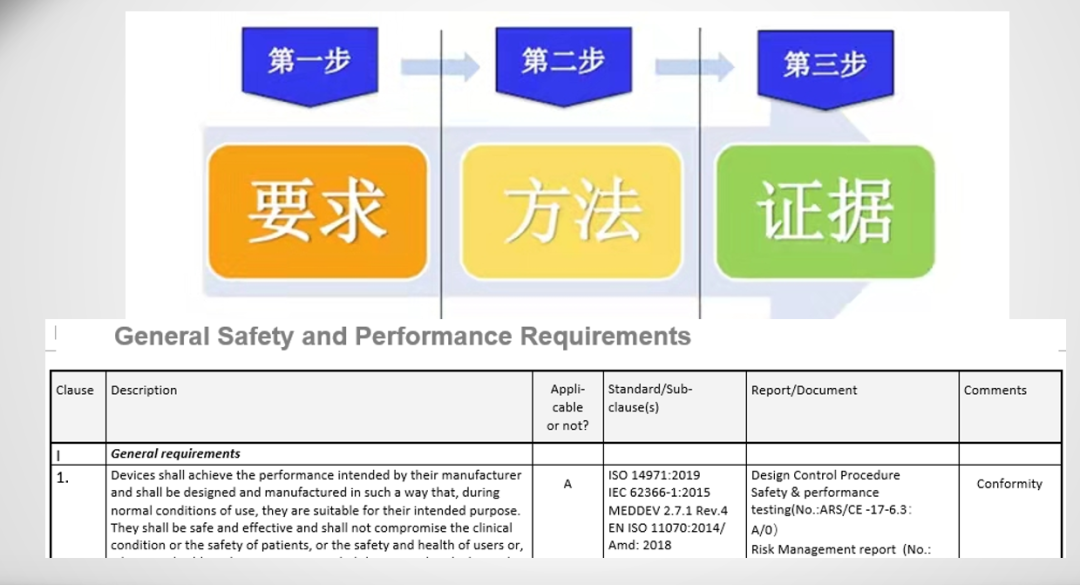
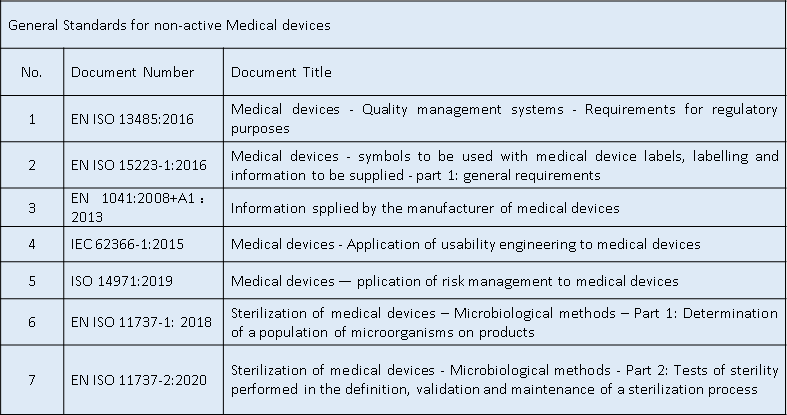
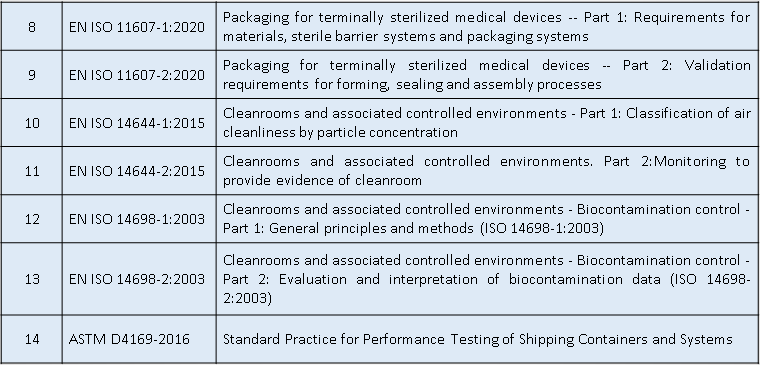
通用安全与性能要求--适用标准
标准选用优先顺序

欧盟官网: https://eur-lex.europa.eu/legal-content/EN/TXT/PDF/?uri=CELEX:32020D0437
欧洲标准化委员会官网CEN: https://standards.cen.eu/dyn/www/f?p=204:105:0:::::
ISO 官网 :https://www.iso.org/search.html
百度搜索 :https://www.baidu.com
适用标准
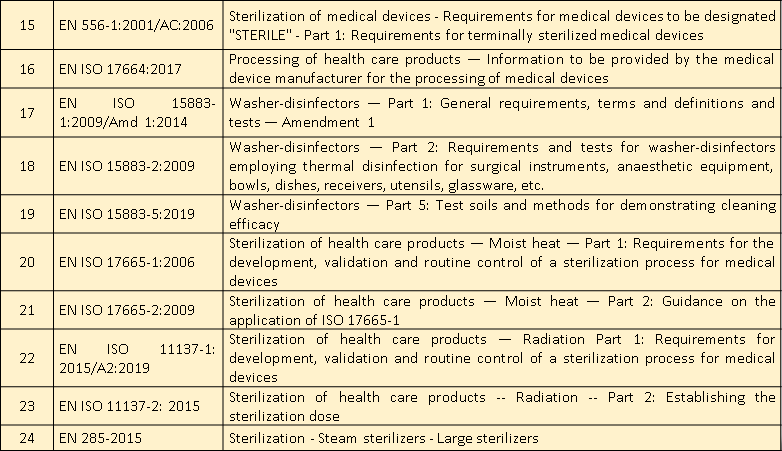
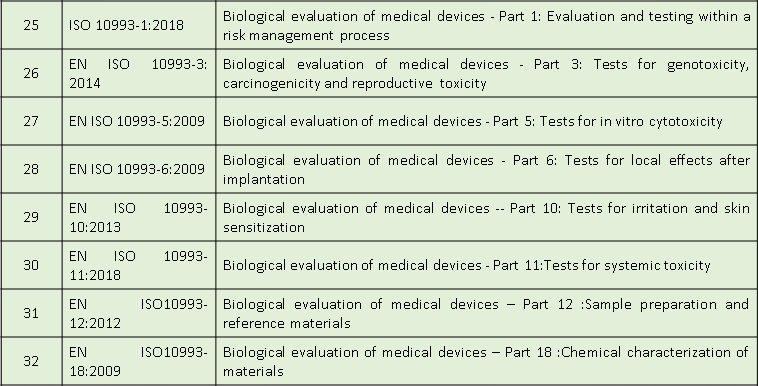
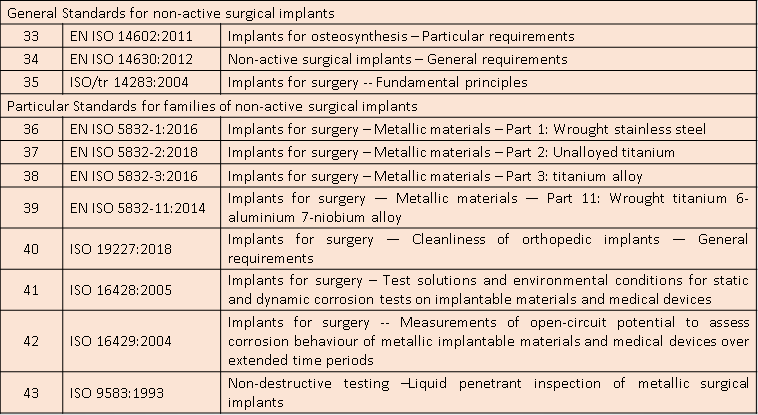
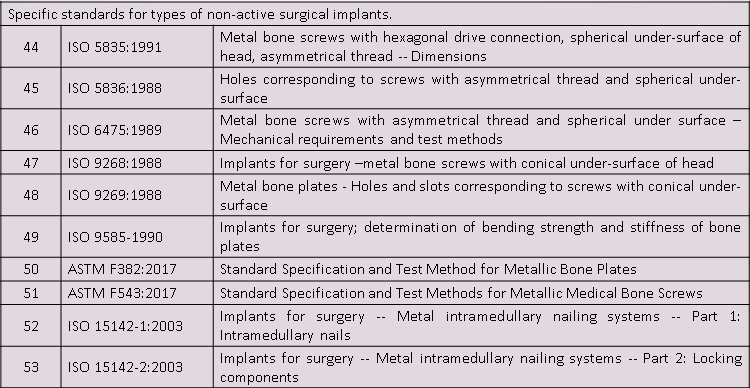
微珂提供专业的CE-MDR认证服务,欢迎来电咨询:
微珂医药拥有海内外专业成熟的技术团队、以及与机构深度的战略合作,服务于医疗器械企业,为企业提供优质的定制化服务,协助企业从产品技术要求编写、产品检测、临床评价资料编写与审核、申报与跟踪,根据企业实际情况,进行质量管理体系建立,帮忙企业从管理到产品各环节一站式服务!
微珂集团服务热线:4001182826!