2022年12月1日,欧盟联邦公报发布了欧盟委员会实施条例《laying down common specifications for the groups of products without an intended medical purpose listed in Annex XVI to Regulation (EU) 2017/745 of the European Parliament and of the Council on medical devices 》。
该条例主要为MDR认证法规(EU)2017/745附录XVI中列出的非预期医疗用途的产品组制定相应的通用规范(Common Specifications,简称CS指南),旨在规范“非预期医疗用途产品”的安全和性能标准,对其风险管理、临床安全评估等做出了具体规定。
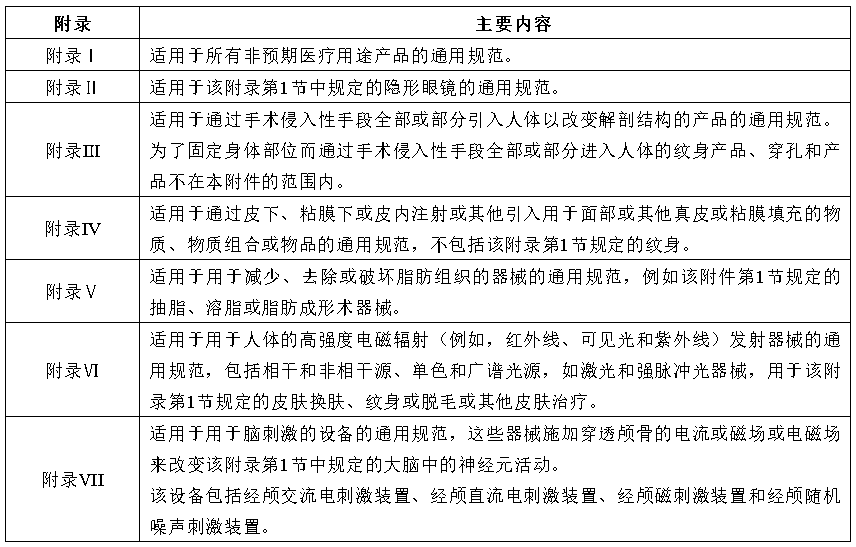
条例的内容主要包含以下7个附录
MDR法规附录XVI中列出的非预期医疗用途的产品清单

过渡期条款
1.为了确认产品符合法规(EU) 2017/745附件I和本法规规定的通用规范中规定的相关一般安全和性能要求,以及根据该法规第52条必须由NB机构参与的合格评定,制造商打算或正在进行临床调查以生成临床评估所需的临床数据的产品,可在2028年6月22日前上市或投入使用,但须满足下列条件:
a. 该产品在2023年6月22日之前已经在欧盟合法销售,并继续遵守2023年6月22日之前适用于该产品的欧盟和国家法律的要求;
b. 产品的设计和预期用途没有重大改变。
根据本款第一条的规定,从2024年6月22日至2024年12月22日,符合该款规定的条件的产品,只有在申办方收到相关成员国根据法规(EU) 2017/745第70(1)或(3)条的通知时,才能投放市场或投入使用。确认产品的临床研究申请已经完成,且临床研究在法规(EU) 2017/745的范围内。
作为对第一分段的规定,从2024年12月23日到2026年6月22日,符合该分段规定的条件的产品只能在申办方已经开始临床研究的情况下投放市场或投入使用。
从2026年6月23日至2028年6月22日期间,符合该段规定的条件的产品,只有在NB机构和制造商签署了履行合格评估的书面协议的情况下,才能投放市场或投入使用。
2. 制造商无意对其进行临床试验,但符合符合性的产品根据该条例第52条,NB机构必须参与的评估,可以列入在2025年6月22日之前上市或投入使用,但须满足以下条件:
a. 该产品在2023年6月22日之前已经在欧盟合法销售,并继续遵守2023年6月22日之前适用于它的欧盟和国家法律的要求;
b. 产品的设计和预期用途没有重大改变。
从2023年9月22日至2025年6月22日期间,符合该段规定的条件的产品,只有在NB机构和制造商签署了履行合格评估的书面协议的情况下,才能投放市场或投入使用。
3.本条例适用的产品,并由NB机构根据指令93/42/EEC签发的证书覆盖,可在第1段第一款和第2段第一款(视情况而定)规定的日期之前,也可在该证书的到期日期之后,投放市场或投入使用,前提是满足以下条件:
a. 该产品在2023年6月22日之前已经在欧盟合法销售,并继续遵守指令93/42/EEC的要求,但由NB机构签发的有效证书的要求除外,如果证书在2021年5月26日之后过期,则该证书需要由NB机构签发;
b. 产品的设计和预期用途没有重大改变;
c. 在由NB机构根据指令93/42/EEC签发的证书到期后,通过由根据指令93/42/EEC签发证书的NB机构或根据法规(EU) 2017/745指定的NB机构和制造商签署的书面协议,确保对本段(a)和(b)中所述条件的符合性进行适当监督。