当地时间2024年3月13日,欧盟委员会发布了最新的第六轮MDR认证/IVDR认证发证情况调查(截止到2023年10月31日),这对于了解医疗器械过渡状态,提前预见和规范欧盟医疗器械的市场至关重要。 
●截止到2023年10月的发展情况
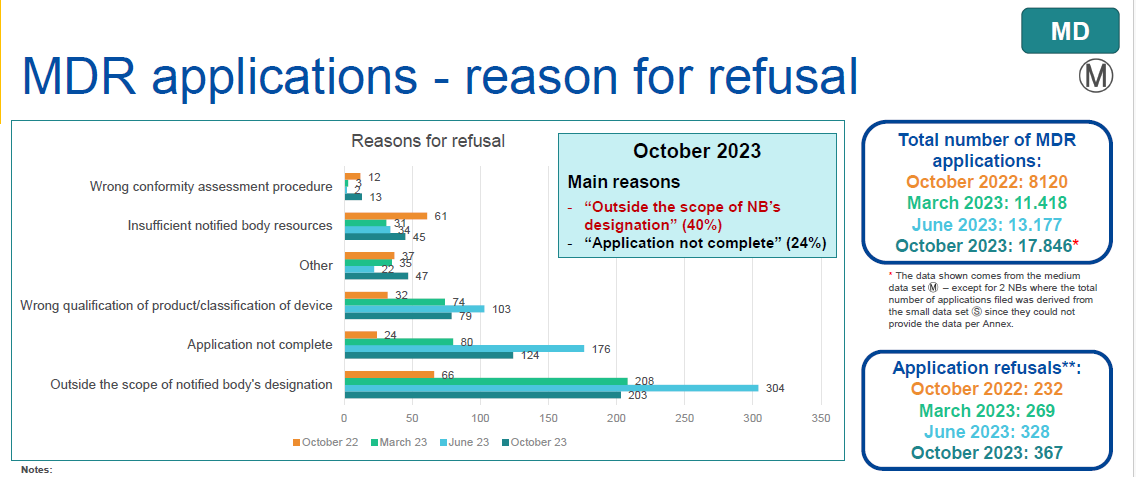
MDR:申请总数量为17846, 发证数量为5599, 发证比例为31.4%。
申请总量中欧盟本土占比47%,欧盟外国家占比:53%。

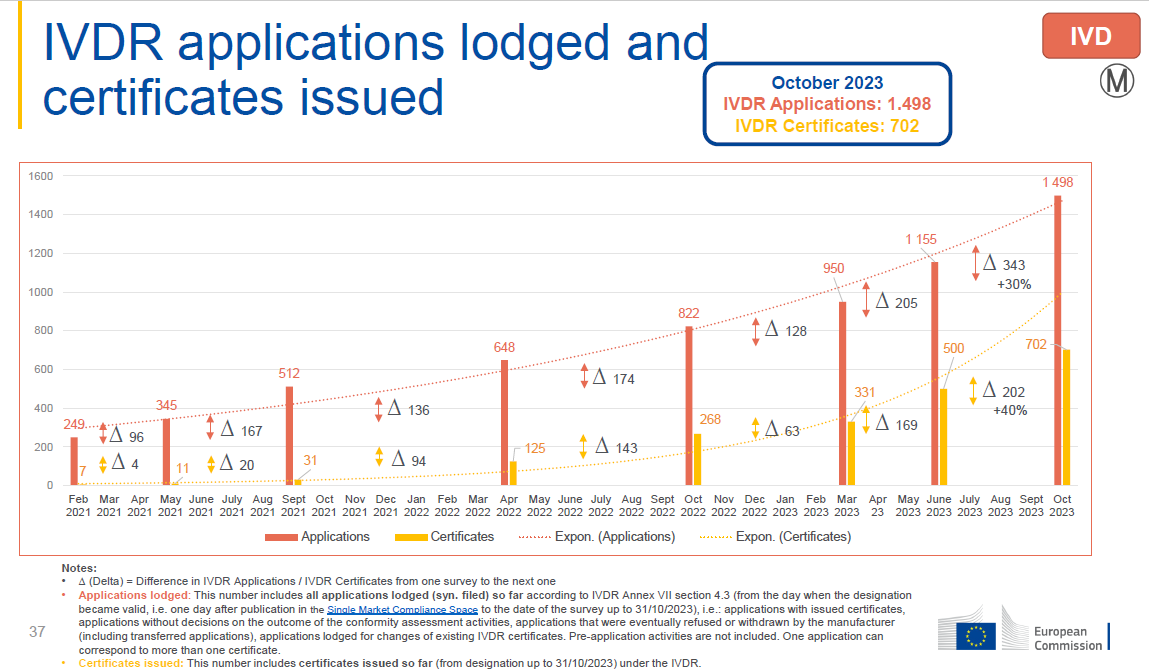
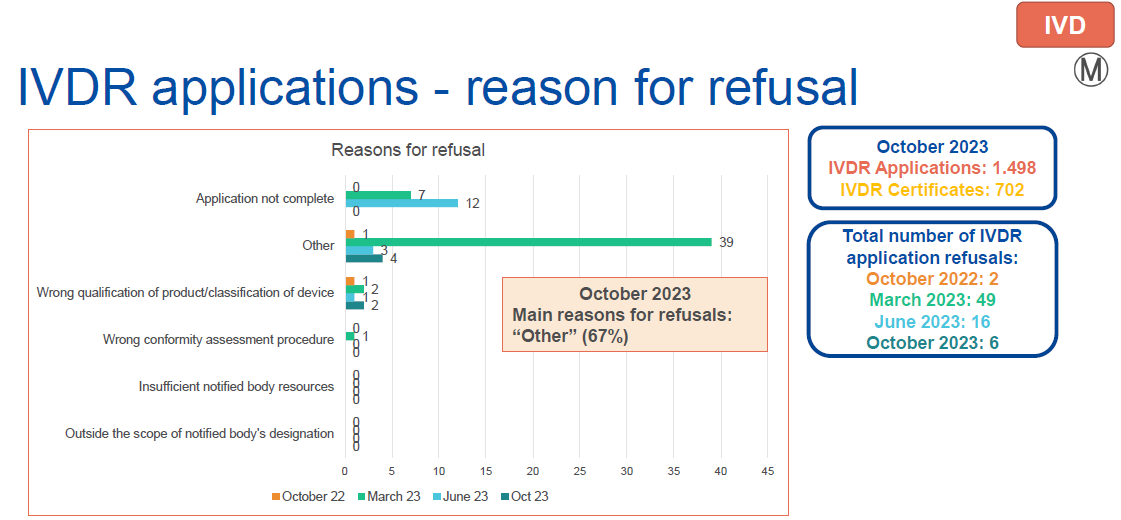
IVDR: 申请数量为1498,发证数量为702,发证比例为46.9%。
申请总量中欧盟本土占比43%,欧盟外国家占比:57%。
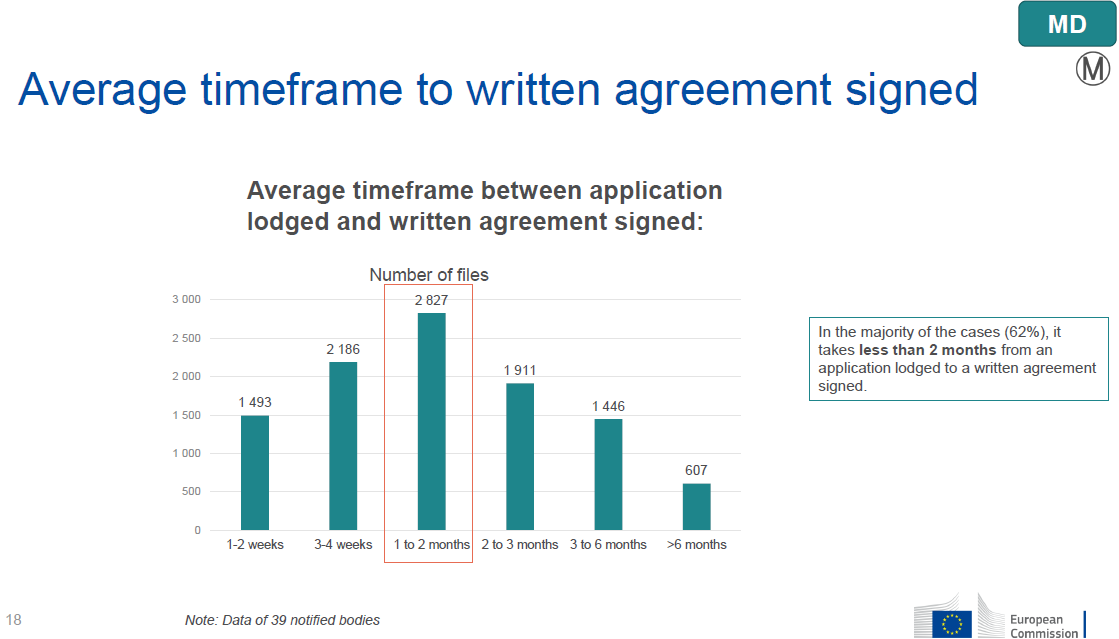
●公告机构签约周期
根据调查:大多数企业从申请到签约在1-2个月之间,对于期望享受MDR过渡期延长的制造商来说:根据延期法规要求,制造商应当在尽早提交申请,并在2024年5月26日前与公告机构达成书面协议。
●MDR/IVDR 申请被拒的原因分析
公告机构表示“超出公告机构的认证范围”、“申请资料不完整”和“产品/设备分类错误”或“其他”原因。整体而言,在已接受的申请中,文件不完整的比率仍旧很高。
●MDR/IVDR 获证时间
微珂友情提醒:医疗器械制造商应当考虑获得新认证所需的时间。
当前MDR认证和IVDR主流认证周期需要13到18个月,该比例占比高达49%(MDR)和67%(IVDR)。
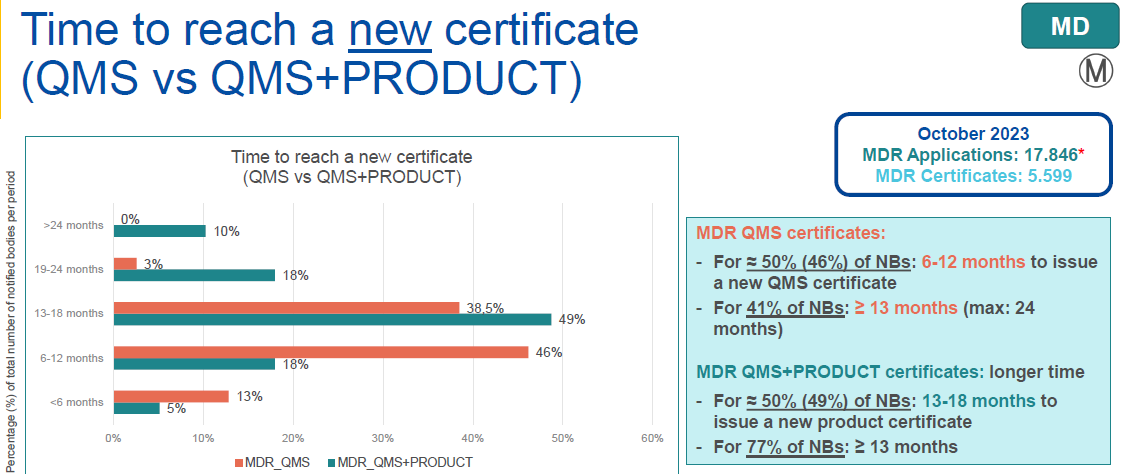
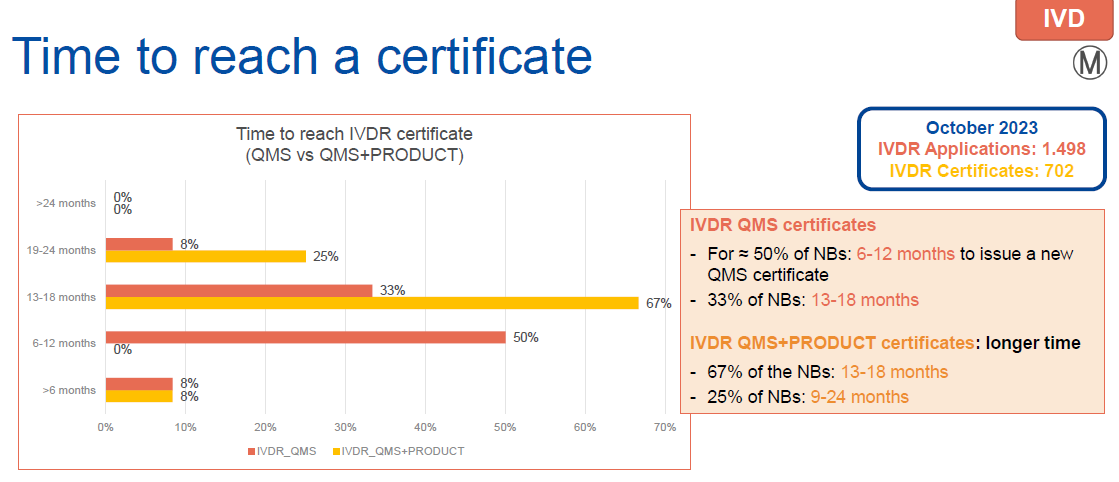
鉴于现在MDR/IVDR认证周期长、认证难度大的特点,对于想通过CE证书进军全球医疗器械市场的制造商而言,尽早确定法规符合性策略至关重要。微珂在CE认证方面沉淀多年,具有丰富的经验,愿为广大制造商早日获证献计献策。